При изучении химических свойств кислорода мы познакомились с реакциями окисления и оксидами. К оксидам, например, относятся вещества, имеющие следующие формулы: Na2O, CuO, Al2O3, SiO2, P2O5, SO3, Mn2O7.
Итак, все оксиды по составу характеризуются тремя общими признаками: любой оксид является сложным веществом, состоит из атомов двух химических элементов, один из элементов – кислород.
Все эти признаки могут быть выражены общей формулой ЭхОу, в которой Э – атомы химического элемента, образовавшего оксид, О – атомы кислорода; х, у – индексы, указывающие число атомов элементов, образующих оксид.
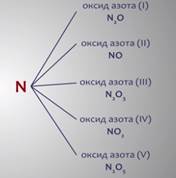
Оксидов много. Практически все простые вещества при окислении образуют оксиды. Атомы многих элементов, проявляя разные значения валентности, участвуют в образовании нескольких оксидов, например, азоту соответствует пять оксидов: оксид азота (I) N2O, оксид азота (II) NO, оксид азота (III) N2O3, оксид азота (IV) NO2, оксид азота (V) N2O5.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!