Изучая химические свойства классов неорганических соединений, мы познакомились с одним из общих свойств солей – взаимодействием их растворов с растворами щелочей. Например, раствор хлорида железа (III) может вступать в реакцию с раствором гидроксида натрия, при этом образуется бурый осадок гидроксида железа (III) и растворимая соль хлорид натрия.
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl.
Если в состав соли входит металл, образующий нерастворимое основание, то эти реакции можно рассматривать и как способ получения нерастворимых оснований.
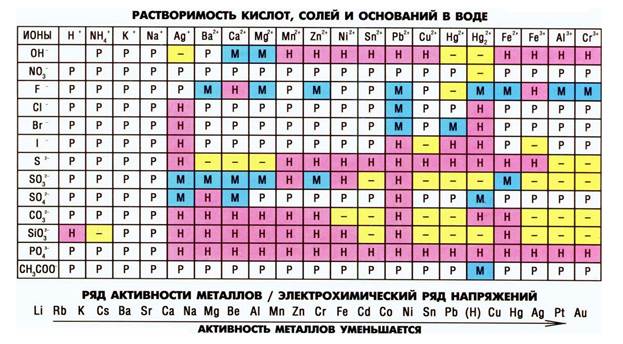
Уже из данного свойства ясно, что способность конкретной соли (например, хлорида серебра, нитрата свинца или любой другой) вступать в те или иные химические реакции зависит от ее растворимости в воде.
Взаимодействие солей со щелочами не единственное их свойство. Они также вступают в реакции замещения с металлами, более активными, чем тот, который образует соль (стоящими в ряду активности металлов левее). Опустим, например, железный гвоздь в голубой раствор сульфата меди (II). Мы увидим, что на гвозде появился темно-красный налет – это выделилась медь, а раствор постепенно побледнел и приобрел желтоватую окраску, свойственную солям железа (II).
Fe + CuSO4 → FeSO4 + Cu.
Многие соли способны вступать в обменные реакции с кислотами и другими солями. Важным условием обменных реакций является образование летучего соединения или осадка среди продуктов, иначе обменная реакция считается обратимой, не протекающей до конца. Образование осадка мы можем предсказать, используя таблицу растворимости солей, оснований и кислот; образование летучего соединения – только зная свойства конкретных соединений. Например, мы знаем, что угольная кислота – очень нестойкое соединение и сразу разлагается на воду и углекислый газ. Н2СО3 → Н2О + СО2↑, поэтому о ее образовании мы будем судить по появлению пузырьков в реакционной смеси. Если к раствору соли угольной кислоты, карбоната натрия, добавить соляную кислоту, то можно будет наблюдать появление пузырьков углекислого газа, который выделяется при разложении образующейся угольной кислоты. Кроме того, в данной реакции образуется и растворимая соль хлорид натрия. Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑.
При взаимодействии солей с другими солями газообразных веществ не образуется, зато может образоваться осадок нерастворимого продукта. Например, при взаимодействии растворов хлорида натрия и нитрата серебра образуется белый хлопьевидный осадок хлорида серебра и раствор нитрата натрия.
NaCl + AgNO3 → AgCl↓ + NaNO3.
Первую в химии классификацию элементов и их соединений дал великий шведский ученый Йенс Якоб Берцелиус.

Хотя его представления о свойствах элементов в дальнейшем были существенно изменены, они сыграли большую роль в последующем развитии классификации веществ.
Приведем в единую систему накопленные нами знания о классификации неорганических веществ.
Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого класса, называется генетической.
Приведем пример цепочки превращений, иллюстрирующей генетический ряд металла кальция.
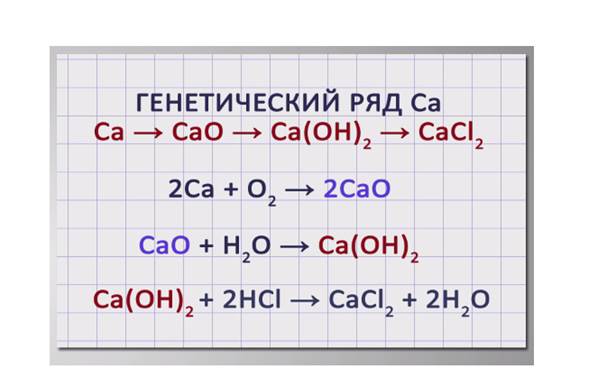
Са → СаО → Са(ОН)2 → СаСl2. Из кальция получим оксид кальция, соединив его с кислородом: 2Са + О2 → 2СаО. Из оксида кальция путем взаимодействия его с водой получим гидроксид кальция: СаО + Н2О → Са(ОН)2. Из гидроксида кальция при его взаимодействии с соляной кислотой можем получить хлорид кальция. Са(ОН)2 + 2HCl → СаСl2 + 2H2O.
Аналогично составим генетический ряд неметалла фосфора.
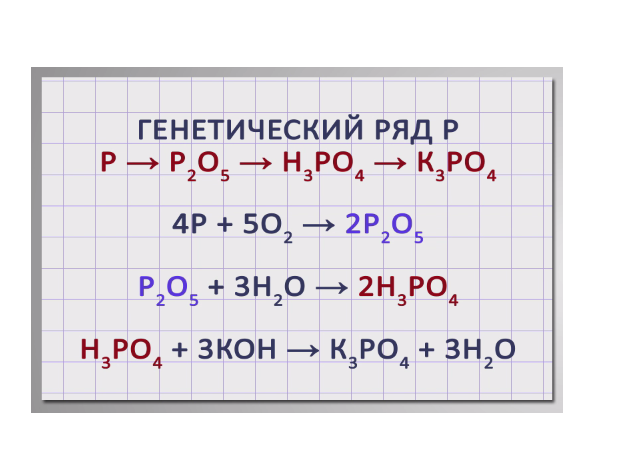
Р → Р2О5 → Н3РО4 → К3РО4. В результате сжигания фосфора в кислороде получим оксид фосфора (V): 4Р + 5О2 → 2Р2О5. Растворением оксида фосфора (V) в воде получим фосфорную кислоту: Р2О5 + 3Н2О → 2Н3РО4. В результате взаимодействия фосфорной кислоты с гидроксидом калия получим фосфат калия:
Н3РО4 + 3КОН → К3РО4 + 3Н2О.
Генетический ряд металла включает сам металл, его основный оксид, гидроксид (основание) и соли.
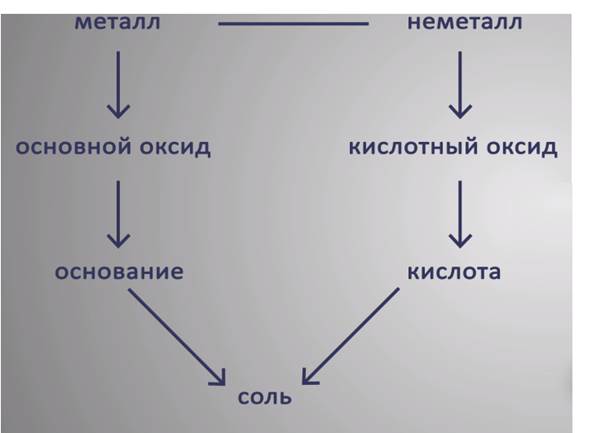
Генетический ряд неметалла состоит из самого неметалла, его кислотного оксида, кислоты и ее солей. Как правило, между собой взаимодействуют вещества, относящиеся к противоположным генетическим рядам. Например, два основных оксида друг с другом не взаимодействуют, зато вступают в реакции с кислотными оксидами.
Таким образом, для основных оксидов характерно взаимодействие с кислотными оксидами и кислотами, для кислотных оксидов – с основными оксидами и щелочами. Кислоты вступают в химическое взаимодействие с металлами, их оксидами и гидроксидами – растворимыми и нерастворимыми. Растворимые основания вступают в химическое взаимодействие с кислотными оксидами, кислотами и растворимыми солями. Нерастворимые основания взаимодействуют только с кислотами. Соли вступают в реакции с металлами, растворимыми основаниями, кислотами и солями.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!