
Вещество может находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Особенности движения и взаимодействия частиц, из которых состоит вещество, объясняет молекулярно-кинетическая теория.
В газах отношение средних значений потенциальной энергии взаимодействия частиц к кинетической энергии движения частиц, из которых состоит тело, много меньше единицы:
![]()
Это значит, что силы притяжения молекул очень малы и не могут удержать молекулы на более близком расстоянии друг от друга. Поэтому газы не имеют собственного объёма и заполняют весь предоставленный объём. При нормальных условиях среднее расстояние между молекулами газа составляет ≈10–9 м. Взаимодействие молекул возникает на расстоянии меньше 1 нм, т.к. молекулы электрически нейтральны и силы взаимодействия являются короткодействующими.
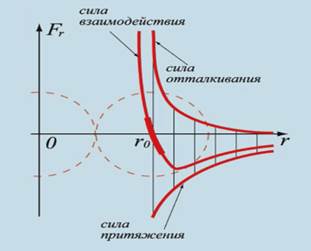
На расстояниях, равных диаметру молекул, сила притяжения равна силе отталкивания. Если молекулы приближаются друг к другу на расстояние меньше диаметра молекул, электронные оболочки атомов перекрываются, и силы отталкивания преобладают над силами притяжения. Поэтому в задачах прибегают к модели газа, в котором не учитывается притяжение молекул. Эту модель газа ввёл в физику в 1857г. немецкий физик Рудольф Клаузиус и назвал её «совершенный газ». Уже позже появился термин идеальный газ.
Идеальный газ – это газ, в котором взаимодействие между молекулами пренебрежимо мало.
Молекулы идеального газа малы по сравнению с объёмом, который они заполняют, поэтому их можно принимать за материальные точки.
При беспорядочном движении молекулы, находясь в сосуде, испытывают соударения со стенками этого сосуда.
Многочисленные удары молекул о стенки сосуда создают давление газа (р).
Основное уравнение молекулярно–кинетической теории выражает зависимость давления газа от квадрата средней скорости движения молекул.
Рассмотрим вывод данного уравнения.
Давление
![]()
По второму закону Ньютона
![]()
Рассчитаем импульс, который получила стенка сосуда.
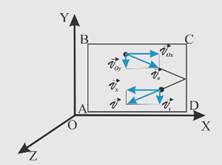
При непрерывном движении молекулы ударяются о стенку сосуда.
Изменение импульса в данном случае будет равно двойному произведению массы молекулы m0 и проекции вектора скорости на ось Ох
![]()
Обозначим через Z число столкновений молекул со стенкой сосуда за данный промежуток времени.
Тогда:
![]()
где
![]()
концентрация (число молекул в единице объёма), S – площадь поверхности.
Импульс, полученный стенкой за 1 секунду
![]()
Изменение импульса
![]()
Отсюда следует, что
![]()
Учитывая, что вследствие беспорядочного движения проекции скорости на оси Оx, Oy, Oz равноправны, то и средние значения квадратов проекций скорости будут равны.
Запишем данное утверждение:
![]()
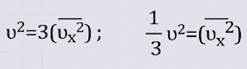
Значит:
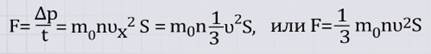
Окончательно имеем:
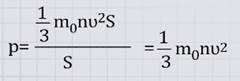
это основное уравнение МКТ уравнение Клаузиуса.
Если учесть, что
![]()
Выполнив подстановку, получаем:
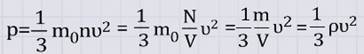
Кинетическая энергия – это энергия движения и вычисляется по формуле:
![]()
в нашем случае учитываем квадрат средней скорости движения молекулы, тогда:
![]()
Основное уравнение МКТ в этом случае имеет вид:
![]()
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
Подведём итоги:
Реальный газ – это достаточно сложная система, и поэтому условно принята простейшая модель газа: «идеальный газ». Идеальный газ в природе не существует, а приближен к нему разряжённый газ.
Модель идеального газа удовлетворяет следующим условиям:
1.Отсутствуют силы межмолекулярного взаимодействия.
2.Только при соударениях молекул возникает взаимодействие, которое является упругим.
3.Молекулы идеального газа не имеют размера и их принимают за материальные точки.
Из формулы основного уравнения МКТ видно, что давление идеального газа зависит от концентрации молекул его плотности и от средней скорости движения молекул. При неизменной температуре газа скорость молекул не изменяется, и давление прямо пропорционально концентрации молекул или плотности газа.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!