Для характеристики состояния атомов в сложных веществах введено понятие «степень окисления». Степень окисления характеризует связанные между собой атомы в ионных и ковалентных полярных соединениях.
Степень окисления – это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
Степень окисления – это количественная характеристика элемента в химическом соединении.
При определении степени окисления атомов элементов исходят из предположения, что в соединении все связывающие атомы валентные электроны перешли к более электроотрицательному элементу, а потому соединение состоит из положительно и отрицательно заряженных ионов.
Степень окисления определяется числом электронов, полностью или частично смещенных от одного атома к другому, с обозначением соответствующего заряда, положительного или отрицательного.
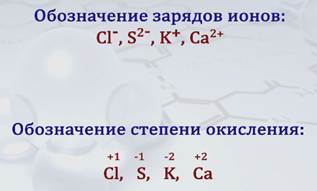
В отличие от обозначения зарядов ионов, которое ставят вверху справа символа элемента, степень окисления также обозначаюn цифрой со знаками «+» или «–», но ее ставят над символом элемента, причем знак «+» или «–» ставят перед цифрой.

Вычисление степени окисления элементов в соединении требует учета валентных электронов и направления их смещения при связывании атомом. Так, в хлориде водорода HCl один электрон водорода смещен в сторону хлора. Водород имеет в соединении степень окисления, равную +1, а хлор –1. У атома азота три внешних неспаренных электрона, у атома водорода – один.
При образовании химической связи в молекуле аммиака NH3, один атом азота как более электроотрицательный элемент оттягивает 3 электрона от 3 атомов водорода. Его степень окисления в соединении равна –3. В целом химическое соединение электронейтрально: сумма положительных степеней окисления равна сумме отрицательных степеней окислении составляющих его элементов.

Степень окисления водорода в соединениях обычно равна +1, а кислорода –2. Степени окисления металлов главных подгрупп I-III групп периодической системы равны номеру группы.
Зная это, легко найти степень окисления других элементов.
Определим степени окисления центральных атомов в соединении, состоящем из трех элементов, например в серной кислоте H2SO4. Для этого сравним значения относительной электроотрицательности элементов, выделим элементы с наибольшим и наименьшим значениями относительной электроотрицательности.
В молекуле серной кислоты наибольшим значением электроотрицательности обладает кислород, следовательно, он имеет отрицательную степень окисления –2. Водород имеет степень окисления, равную +1.
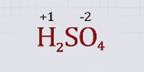
Запишем значения известных степеней окисления водорода и кислорода над формулой серной кислоты. Вычислим степень окисления третьего элемента – серы, приняв ее значение за х, в соответствии с правилом равенства сумм положительных и отрицательных степеней окисления.
–2 · 4 = –8
Значит, 1 · 2 + х = 8, х = 6.
Запишем значение степени окисления серы +6 над формулой серной кислоты.
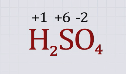
Высшая положительная степень окисления элемента обычно равна номеру группы периодической системы. Так, кальций находится во II группе, следовательно, его высшая степень окисления равна +2, у элемента V группы азота она равна +5.
Высшая степень окисления углерода и кремния равна +4, низшая равна –4.
Многие элементы, и особенно элементы побочных подгрупп, имеют переменную степень окисления. Так, например, марганец имеет степень окисления в разных его соединениях +2, +3, +4, +6, +7.
Степень окисления тесно связана с относительной электроотрицательностью элемента, а также обусловлена его местом в периодической системе Дмитрия Ивановича Менделеева.
В природе элементы встречаются в соединениях, где проявляют характерную и устойчивую степень окисления. Так, у кислорода такой устойчивой степенью окисления является –2, но в соединении с более электроотрицательным элементом фтором он имеет положительную степень окисления +2
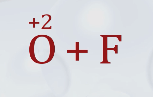
В свободном атомарном состоянии и в простых веществах степень окисления элементов равна нулю, так как их валентные электроны не смещены.
Степень окисления не следует отождествлять с валентностью элементов.
Валентность – это реальное свойство атомов, которое проявляется в их способности образовывать химические связи с другими атомами. Валентность в ковалентном соединении измеряется числом химических связей или числом связывающих электронных пар.
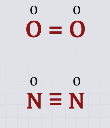
Так, молекула О2 образована двумя ковалентными связями, валентность кислорода в данном веществе равна II, а степень окисления равна нулю. Молекула азота образована с помощью трех ковалентных связей, следовательно, азот здесь трехвалентный.
В большинстве случаев численные значения валентности и степени окисления элементов в соединениях совпадают, но не во всех случаях они численно равны. Например, в пероксиде водорода Н2О2 степень окисления кислорода равна –1, так как от водорода к атому кислорода оттягивается лишь один электрон, а у атомов кислорода одинаковая электроотрицательность.
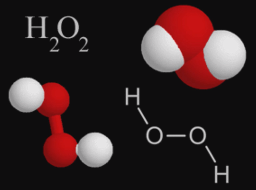
Понятие валентности применимо лишь к ковалентным соединениям, как простым, так и сложным.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!