Сравнительно небольшое число элементов периодической системы Дмитрия Ивановича Менделеева – 118 - образуют около 10 миллионов простых и сложных веществ. Причина этого явления заключена в том, что, взаимодействуя между собой, атомы многих элементов связываются друг с другом, образуя разные химические соединения.
Сила, соединяющая два или несколько взаимодействующих атома в молекулы или другие частицы, называется химической связью.
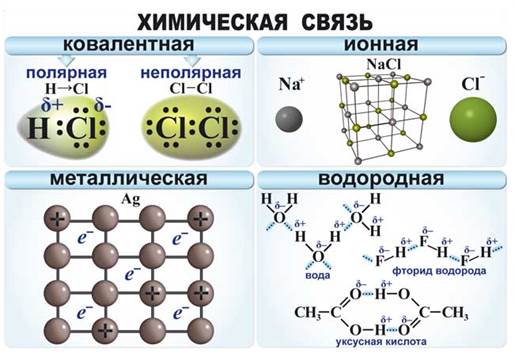
Известны виды химической связи: ковалентная неполярная, ковалентная полярная, ионная, металлическая и другие.
Причиной образования химической связи является стремление атомов металлов и неметаллов путем взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных элементов.
При образовании химической связи существенно перестраиваются электронные структуры связывающих атомов, следовательно, меняются их многие свойства в соединениях.
Химические связи между атомами возникают в ходе химических реакций. Соединение атомов осуществляется с помощью валентных электронов.
Валентностью называется способность атомов элементов образовывать химические связи.
Валентными называются электроны, которые могут участвовать в образовании химической связи.

Валентные электроны находятся в атоме на внешнем энергетическом уровне, а у элементов побочных подгрупп - и на предвнешних электронных слоях.
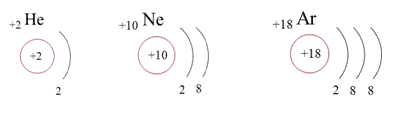
Валентные электроны — это неспаренные электроны внешнего электронного слоя. У атомов инертных элементов все электроны спарены. Они химически инертны. У атомов металлов и неметаллов в валентных электронных слоях имеются неспаренные электроны. Такие атомы реакционноспособны, то есть способны образовывать химические связи.
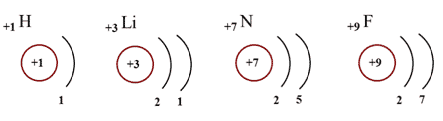
Валентные возможности атомов элементов, то есть их способность к образованию химических связей, определяются прежде всего числом неспаренных электронов.
Чтобы определить число неспаренных электронов, надо воспользоваться формулой:
8 – № группы = число неспаренных электронов.
8 – число электронов на завершенном внешнем электронном слое.
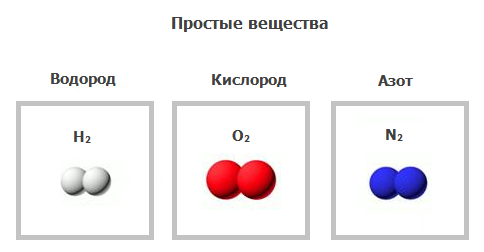
Наблюдения и опыты позволили нам убедиться в реальности существования простых веществ – водорода, кислорода, азота. Мы изучили их состав и свойства. Водород, кислород, азот по составу – простые вещества, по строению – молекулярные, при обычных условиях находятся в газообразном состоянии. Возникает вопрос, как атомы водорода, кислорода и азота связываются в двухатомные молекулы?
Рассмотрим процесс образования молекул водорода.
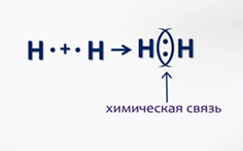
Два атома водорода при их сближении и взаимодействии друг с другом могут образовать двухатомную молекулу. Каждый атом водорода имеет по одному неспаренному электрону.
При взаимодействии атомов водорода электроны «объединяются» и становятся общими для обоих атомов, у которых формируется завершённый внешний электронный слой, подобный завершённому уровню атома гелия.
Итак, химическая связь между атомами водорода осуществляется обобществленной парой электронов. Каждый из атомов отдает на образование связи по одному своему электрону.
С учетом сказанного выше составим схему образования молекулы водорода.
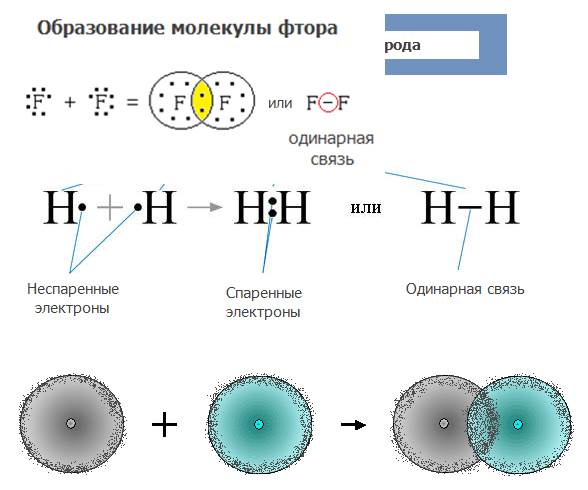
Подобным образом осуществляется связь между атомами фтора, у них формируется завершённый внешний восьмиэлектронный уровень.
В молекулах водорода и фтора атомы связаны одной общей электронной парой. Такую связь называют одинарной.
Химическая связь между атомами в молекулах может быть образована с помощью большего числа электронных пар. Это зависит от строения взаимодействующих атомов.
Рассмотрим, как образуется молекула азота.
Химический элемент азот расположен в VА группе периодической системы элементов, следовательно, на внешнем электронном слое у атома азота находится 5 электронов, из которых 3 – неспаренных.
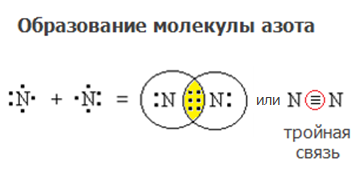
С помощью обобществления электронных пар объединяются атомы в двухатомной молекуле азота N2.
Связь между атомами здесь тройная.
Американский физикохимик Гилберт Ньютон Льюис ввел электронные формулы веществ, отражающие природу ковалентной связи, которые затем назвали формулами Льюиса. В этих формулах валентные электроны внешнего слоя условно изображены точкой. В них ковалентная связь или связи обозначены общей электронной парой.
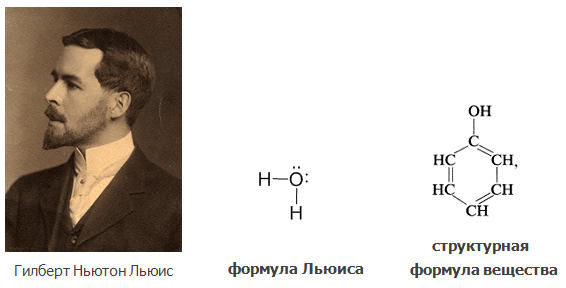
Если электронные пары, осуществляющие химическую связь, обозначать также черточками, получается структурная формула вещества.
Увеличение числа электронных пар, связывающих атомы в молекулу, увеличивает прочность молекул.
Химическая связь между атомами, осуществляемая общими электронными парами, называется ковалентной.
Приставка «ко» означает «совместное участие». В данном случае – участие двух атомов в реализации своей валентности. С помощью ковалентной связи между атомами неметаллов образуются молекулы простых веществ, а также многих сложных веществ.
Ковалентная связь устанавливается между атомами не только одного элемента, но и разных элементов с близкими значениями их электроотрицательности и близкими химическими свойствами. Примером таких соединений могут служить молекулы фторида и хлорида водорода, воды, аммиака, оксида углерода (IV).
Рассмотрим установление химической связи между атомами разных элементов-неметаллов на примере образования фторида водорода. Запишем схему электронных структур атомов водорода и фтора. У каждого из атомов имеется по одному неспаренному электрону. При взаимодействии этих электронов может образоваться общая электронная пара, связывающая атомы разных элементов. Связывающая их электронная пара принадлежит обоим атомам.
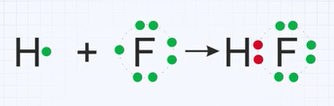
Эта химическая связь также ковалентная. Она осуществляется электронной парой, для образования которой каждый из этих атомов поставляет по одному электрону.
С помощью ковалентной связи образуются молекулы многих сложных веществ, состоящие из нескольких атомов, например, молекулы воды, аммиака и других.
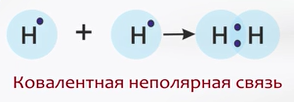
Сравним между собой характер ковалентной связи в молекулах простых и сложных веществ. В молекулах простых веществ водорода, кислорода, хлора, азота между собой связаны атомы одного и того же элемента с одинаковой электроотрицательностью. Взаимодействующие атомы в равной степени присваивают к себе связывающую их электронную пару, и она оказывается одинаково удаленной от центров ядер обоих атомов. Эта связь является ковалентной неполярной.
Химическая связь между атомами одного элемента в простом веществе, осуществляемая общей электронной парой (парами), положенной на равном удалении от ядер обоих связывающихся атомов, называется ковалентной неполярной.
В сложных веществах общие электронные пары связывают атомы разных элементов, имеющих разную электроотрицательность. В этом электронная пара (пары) смещена в сторону более электроотрицательного элемента, например, в молекуле фторида водорода она смещена к атому фтора. Связывающая атомы электронная пара (пары) располагается асимметрично относительно их ядер. Вследствие этого ковалентная связь становится полярной. У более электроотрицательного элемента скапливается избыток отрицательного заряда, у менее электроотрицательного – избыток положительного заряда.
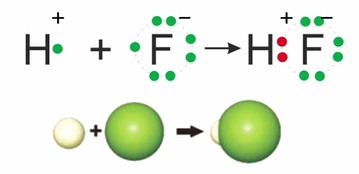
Чем больше различаются электроотрицательности взаимодействующих атомов, тем больше смещена общая электронная пара к наиболее электроотрицательному атому, тем полярнее химическая связь между атомами.
Ковалентная химическая связь между атомами разных элементов, при которой общая электронная пара (пары) смещена в сторону наиболее электроотрицательного элемента, называется ковалентной полярной.
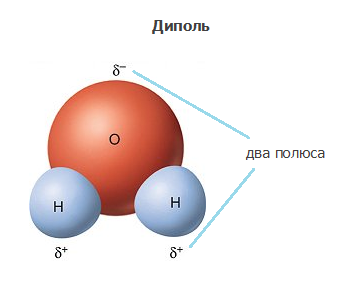
Молекулы хлороводорода, воды, аммиака также являются полярными. Их ещё называют диполями (имеющими два полюса).
Для характеристики ковалентной связи необходимо знать её свойства. К таковым относятся прочность (энергия), длина, направленность, полярность, насыщаемость. С полярностью ковалентной связи мы уже познакомились.
Важнейшим свойством ковалентной связи является ее прочность. Она определяется энергией связи. Мы знаем, что при образовании химической связи выделяется энергия – это экзотермический процесс. При образовании водорода выделяется 431 кДж/моль, при образовании фтороводорода – 565 кДж/моль.
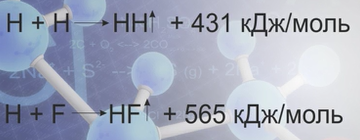
Длина связи – другое ее свойство. Длину связи измеряют в нанометрах (1 нм = 1 · 10-9 м). Длина связи зависит от радиуса взаимодействующих атомов, от кратности связи между ними. Прочность молекул увеличивается с уменьшением длины между их атомами и повышением ее энергии.
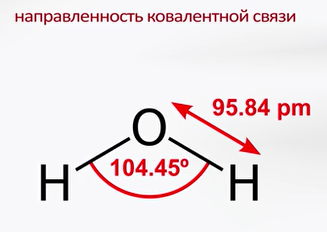
Направленность ковалентной связи. Установлено, что при взаимодействии кислорода с атомами водорода образуются две химические связи О-Н. В молекуле воды они образуют угол. Однако экспериментально установлено, что угол связи Н-О-Н в молекуле воды равен не 90°, а 104,5° вследствие их взаимного отталкивания. Поэтому угол между связями О-Н в молекуле воды увеличивается. Направленность химических связей в молекуле определяет её пространственную форму или «геометрию» молекул. У молекулы воды угловая форма. Позже мы узнаем причину этого.
Молекулы разных веществ могут иметь линейное, угловое, пирамидальное и другое строение, плоскостную и неплоскостную формы.
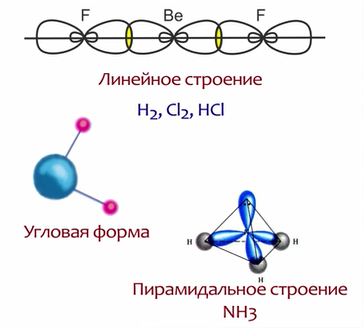
Двухатомные ковалентные молекулы Н2, Сl2, НCl и другие линейной формы. Трехатомные молекулы могут иметь линейную, как СО2, или угловую, как Н2О, форму. У четырехатомных молекул аммиака пирамидальное строение. Причины разной геометрии молекул мы узнаем позже.
Насыщаемостью связи называют способность атомов образовывать строго определенное число ковалентных связей.
Зная важнейшие характеристики химической связи и геометрию молекул, можно предсказать многие свойства вещества.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!