Периодическую систему химических элементов создал в 1869 году наш великий соотечественник Дмитрий Иванович Менделеев.
В отличие от своих предшественников, Менделеев сравнивал не только сходные, но главным образом несходные между собой элементы и их группы (например, щелочные металлы и галогены), располагая их на основе главной (известной к тому времени) характеристики элемента – атомного веса.
Формулировка закона в то время была такова:
Свойства химических элементов, а также свойства и формы их соединений находятся в периодической зависимости от их атомных весов.
Позже Менделеев использовал введенную им более фундаментальную, чем атомный вес, характеристику элементов, а именно их порядковый номер, который определяется положительным зарядом ядра, т.е. числом протонов в ядре атома. Были установлены закономерности изменения свойств элементов в периодах и группах.
Для описания и систематизации химических элементов необходимо знать их характеристики: порядковый номер (заряд ядра его атомов) и относительную атомную массу.
Из них заряд ядра атомов является общей, неизменной при химических реакциях главной характеристикой для определения элемента.
Для описания элементов, кроме перечисленных выше количественных характеристик, нужны и другие, в том числе качественные характеристики элемента. Таковыми являются электронное строение и свойства его атомов.
Особое значение имеют электроны, расположенные на внешнем электронном слое, валентные электроны. У элементов-металлов их обычно 1 – 2, реже 3, у неметаллов – 4 и больше. У элементов больших периодов побочных подгрупп валентными являются электроны не только внешнего, но и предвнешнего слоя. От валентных электронов зависит реакционная способность атомов к образованию химических связей с другими атомами, к образованию химических соединений.
Химическое соединение – это химически индивидуальное вещество, состоящее из химически связанных атомов одного в простом или нескольких в сложном веществе элементов, имеющее определённый состав.
Простые и сложные вещества – это формы реального существования элементов в природе. Характер элементов влияет на свойства образованных ими веществ, и наоборот, зная свойства веществ, можно судить о характере элемента.
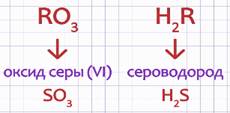
Дмитрий Иванович Менделеев придавал большое значение знанию форм и свойств типичных кислородных и водородных соединений элемента для его характеристики. Под формой соединений он понимал сходство в составе типичных для группы элементов их соединений, выраженное общими формулами. Так, элементы главной подгруппы VI группы периодической системы имеют следующие формы кислородных и водородных соединений: RO3, H2R.
Например: оксид серы и сероводород.
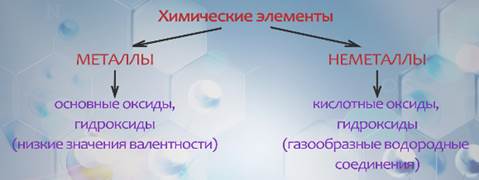
Типичные металлические элементы образуют основные оксиды и гидроксиды, проявляя в этих формах соединений низкие значения валентности. У неметаллических элементов высшие кислородные соединения (оксиды и гидроксиды) имеют кислотный характер. Эти элементы образуют газообразные водородные соединения. Многие элементы проявляют промежуточные свойства.
Выведем закономерности изменения свойств элементов с увеличением их порядкового номера.
1.Важнейшие количественные характеристики элемента – заряд ядра его атомов и атомная масса – возрастают монотонно.
2.Структуры внешнего электронного слоя изменяются скачкообразно.
3.Периодически повторяются формы и свойства оксидов и гидроксидов элементов.
4.Периодически повышается валентность элементов по кислороду и уменьшается по водороду.
Какова зависимость между характеристиками элемента, меняющимися монотонно и периодически?
Рассмотрим эту связь на примере заряда ядра атомов и их внешних электронов. Для этого построим график. Отметим на горизонтальной линии заряд ядра атома, а на вертикальной – число электронов на внешнем слое атомов элементов.
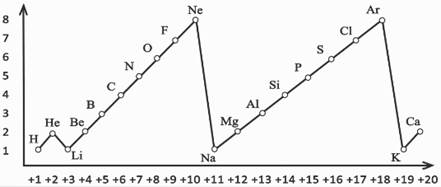
Число электронов внешнего электронного слоя атомов элементов периодически изменяется при монотонном возрастании величины заряда ядра их атомов.
Открытие периодического закона ознаменовало начало новой эпохи в развитии химии – ее современного этапа. До этого накопленные в науке факты не имели внутренней связи.
Периодический закон раскрыл глубокую связь между элементами, позволил ученым предсказывать свойства еще не открытых элементов и их соединений и целенаправленно осуществлять поиск новых.
Дмитрий Иванович Менделеев не сомневался в достоверности открытого закона, твердо верил в его будущее, в его развитие. Незадолго до смерти он написал: «...периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает».
Периодический закон:
– утвердил глубокую внутреннюю связь между элементами;
– позволил ученым предположить, что все атомы построены по общему плану;
– тем самым создал предпосылку для перехода к новому этапу развития науки, к познанию внутренней структуры атомов – открытие электрона, радиоактивности, разработка теории строения атома и т.д.
Следующим этапом стало раскрытие физической сущности закона на основе теории строения атома.
Вы уже знакомы со строением атомов и знаете, что заряд ядра атома – его главная характеристика. Заряд ядра совпадает с порядковым номером элемента в периодической системе Менделеева.
Ученик Резерфорда английский учёный-физик Генри Мозли установил в 1913 году, что длина волны рентгеновского излучения у каждого элемента своя. Она увеличивается с возрастанием атомной массы. Мозли связал частоту этого излучения с порядковым номером элемента. Закон Мозли подтвердил, что изменение Менделеевым порядковых номеров элементов в периодической системе соответствовало последовательному увеличению зарядов ядер их атомов. Этот вопрос мы уже обсуждали при изучении изотопов.
В связи с новыми открытиями в области строения атома периодический закон принял следующую современную формулировку:
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома.
Почему свойства элементов и их соединений изменяются периодически?
В чем причина периодичности?
Ответ на данный вопрос также позволяет дать теория строения атома:
Величина заряда ядра – главная характеристика элемента, мера его индивидуальности. От этой характеристики элемента зависят все остальные его свойства, она определяет число электронов и их состояние в атоме.
Возрастание зарядов ядер атомов от первого до последнего элемента приводит к периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне. В этом физический смысл периодического закона и причина периодичности изменения свойств элементов.
Периодическое изменение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и электронных структур атомов.
Теория строения атома способствовала развитию периодического закона и периодической системы химических элементов, определению их современного содержания. Она дала импульс к изучению внутреннего строения веществ, к открытию и получению новых элементов.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!