В зависимости от того, как общая электронная пара размещается по отношению к ядрам взаимодействующих атомов, различают разные виды химической связи: ковалентная, ионная, металлическая и водородная.
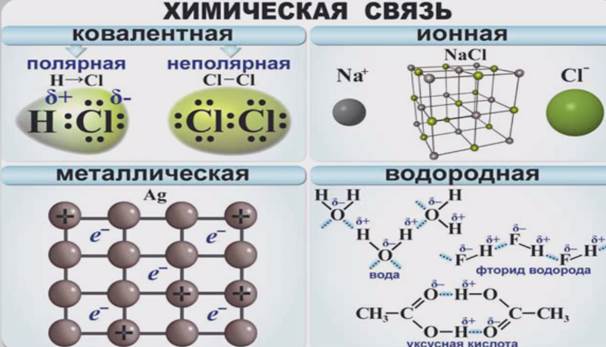
Тема этого урока – ковалентная связь. Один из существенных показателей, определяющих, какая связь образуется между атомами – ионная или ковалентная – это электроотрицательность.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!