Тема урока: «Роль теории строения атома в объяснении образования химической связи». Для описания соединения двух атомов используют термин «химическая связь».В образовании химической связи участвуют валентные электроны.
Свойство атомов того или иного элемента образовывать определенное число ковалентных связей называют валентностью.Валентность определяется числом неспаренных электронов, числом неподеленных электронных пар и числом вакантных атомных орбиталей на валентном слое атомов данного элемента. Валентные возможности того или иного элемента легко определить, исходя из электронной конфигурации валентного слоя его атомов.
Рассмотрим валентные возможности серы. Электронная конфигурация серы в основном стационарном состоянии.
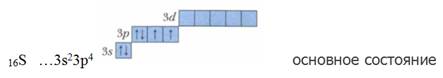
В основном (невозбужденном) состоянии у атома серы два неспаренных электрона, следовательно, сера может проявлять валентность II (например, в соединениях H2S, SCl2). При возбуждении атома происходит распаривание p-электронной пары, один из электронов переходит на 3d-подуровень. И тогда электронная конфигурация серы в ее первом возбужденном состоянии будет следующая:
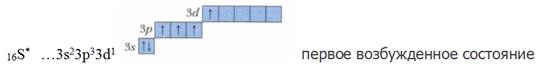
В этом случае в атоме серы четыре неспаренных электрона, следовательно, сера может проявлять валентность IV(например, в соединении SO2).
При повторном возбуждении атома произойдет распаривание s-электронной пары, и один из s-электронов перейдет на d-подуровень. Электронная конфигурация серы во втором возбужденном состоянии:

В этом случае в атоме серы окажется шесть неспаренных электронов на валентном слое, значит, атом серы может образовывать шесть ковалентных связей, следовательно, сера будет проявлять валентность VI (например, в соединениях SO3, SF6).
Валентные возможности определяются не только числом неспареннных электронов, но и числом неподеленных электронных пар, способных переходить на свободные орбитали атомов другого элемента. Так, например, атом кислорода может передать одну из неподеленных электронных пар на вакантную орбиталь иона водорода с электронной конфигурацией1s0 и образовывать ион гидроксония.
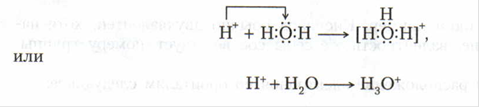
Таким образом, атом кислорода в ионе гидроксония трехвалентен.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!