Периодический закон был открыт Д.И. Менделеевым в 1869 г. Современная формулировка этого закона такова: свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от зарядов ядер их атомов.

Графическим следствием закона Д.И. Менделеева является периодическая система элементов, в которой Д.И. Менделеев расположил элементы в порядке возрастания их атомного веса и выделил вертикальные столбцы сходных по свойствам элементов.
В таблице химических элементов Д.И. Менделеева семь периодов и восемь вертикальных столбцов (групп).
Рассмотрим структуру периодической таблицы с точки зрения периодичности изменения электронных конфигураций составляющих ее элементов.
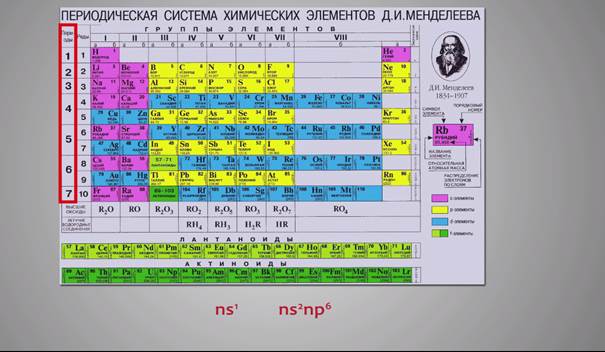
Горизонтальные ряды образуют периоды. Все периоды (кроме первого) начинаются щелочным металлом с конфигурацией внешнего электронного слоя ns1и заканчиваются инертным элементом с конфигурацией внешнего электронного слоя ns2np6.
Номер периода совпадает с числом энергетических уровней атома, заполняемых электронами. Так, например, у атомов элементов первого периода электронная оболочка состоит из одного электронного слоя, электронная оболочка атомов второго периода состоит из электронов, расположенных на двух энергетических уровнях, и т.д.
Теперь обратимся к вертикальным рядам периодической системы – группам.
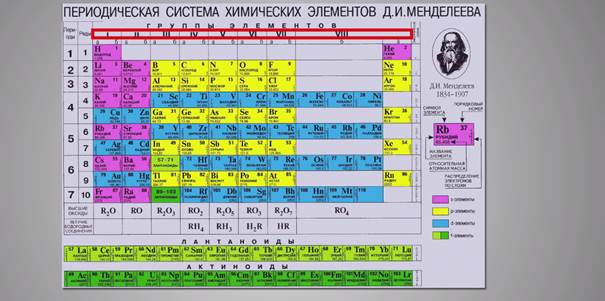
Их восемь, причем каждая группа состоит из двух подгрупп – главной (A) и побочной (B).
Деление групп на подгруппы объясняется различием электронных конфигураций атомов составляющих их элементов.
Для элементов главных подгрупп накапливание электронов происходит на последнем уровне – последними заполняются либо s-орбитали (s-элементы), либо p-орбитали (p-элементы).
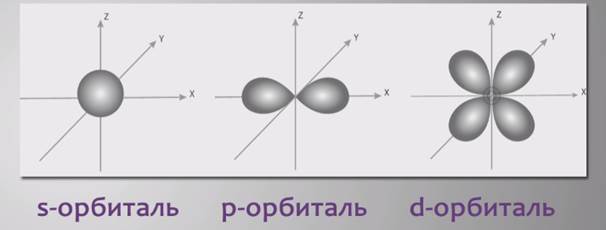
У элементов первой главной подгруппы на внешнем слое
1s-электрон, у элементов второй – 2s-электрона, у элементов третей – 3 электрона и строение внешней оболочки ns2np1 и так далее до главной подгруппы восьмой группы: у инертных газов завершено строение внешнего уровня ns2np6.

Таким образом, число электронов на внешнем уровне равно номеру группы.
Для элементов побочных подгрупп накапливание электронов происходит на предпоследнем энергетическом уровне. На внешнем последнем уровне сохраняется по два или одному s-электрону. У лантаноидов и актиноидов при одинаковом строении внешнего s- и предвнешнего d- подуровней заполняется третий снаружи f-подуровень.
Во всяком случае, у элементов одной подгруппы строение внешнего уровня электронной оболочки всегда одинаковое.
Рассмотрим, например, V группу периодической системы элементов.
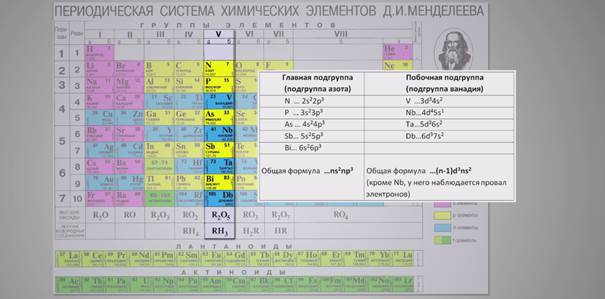
Мы видим, что главную подгруппу образуют p-элементы, а побочную
подгруппу – d-элементы.
Необычное строение имеет VIII группа. В ней не одна, а три побочных
подгруппы – железа, кобальта и никеля.
Их образуют так называемые триады близких по химическим свойствам переходных элементов Fe – Co – Ni, Ru – Rh – Pd, Os – Ir –Pt.
Сходство строения электронных оболочек атомов элементов приводит к сходству их физических и химических свойств.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!