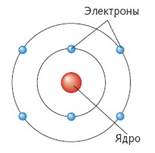
Свойства электронов описываются законами микромира. Экспериментально и теоретически установлено, что электроны как микрочастицы обладают двойственной природой, то есть для них характерны свойства как частицы – они имеют определенную массу и размеры, так и волны – они не имеют траектории движения, определенного положения в пространстве.
Быстро движущийся электрон может находиться в любой точке пространства, окружающего ядро атома, и на разном удалении от него, образуя электронную оболочку. Поэтому принято говорить о вероятности пребывания электрона в той или иной части внутриатомного пространства. Электрон движется вокруг ядра с огромной скоростью, при которой его отрицательный заряд как бы размазывается в пространстве. Максимальная плотность отвечает наибольшей вероятности пребывания электрона в данной области атомного пространства.
Электроны в атоме различаются своей энергией. Чем ближе электроны находятся к ядру, тем они прочнее связаны с ним и их труднее «вырвать» из электронной оболочки. Чем дальше располагаются электроны от ядер атомов, тем легче их «оторвать». Именно внешние электроны участвуют в образовании связей между атомами в молекулах.

В электронной оболочке атома электроны располагаются в определенном порядке. Условно можно считать, что они размещаются слоями. Эти слои не имеют четких границ и постепенно переходят друг в друга.
Каждый электронный слой состоит из электронов с близкими значениями энергии, поэтому их еще называют энергетическими уровнями. Число энергетических уровней или электронных слоев в атоме совпадает с номером периода периодической системы, в котором находится соответствующий химический элемент. Установлено, что в первом слое (ближайшем к ядру атома) находится максимальное число электронов – 2. Во втором слое может располагаться максимально 8 электронов, в третьем слое – 18 электронов, а в четвёртом – 32 электрона. Таким образом, максимальное число электронов, находящихся на энергетическом уровне, можно определить по формуле 2n2, где n – номер энергетического уровня.

Слой в атоме, содержащий максимально возможное для него число электронов, называют завершённым энергетическим уровнем.
Например, атом водорода имеет в периодической системе Д.И. Менделеева порядковый номер 1, следовательно, заряд ядра атома равен +1, и в его электронной оболочке находится 1 электрон. Следующий элемент в 1-м периоде – гелий. Заряд ядра атома гелия +2, количество электронов – 2. У гелия электронный слой завершен. У лития появляется второй энергетический уровень, поэтому он находится во 2-м периоде периодической системы.
Далее в атомах элементов 2-го периода происходит заполнение второго электронного слоя до 8 электронов у неона.
У следующего по порядку атома, натрия, появляется третий энергетический уровень.
Слой, для которого характерна наименьшая энергия взаимодействия электрона с ядром, называется внешним. Внешний энергетический уровень всегда содержит не больше 8 электронов, кроме атомов элементов 1-го периода, поскольку максимальное количество электронов первого слоя – 2. Если элемент находится в главной подгруппе периодической системы, то число внешних электронов в его атоме равно номеру группы.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!