
По первому положению молекулярно-кинетической теории все тела состоят из огромного числа молекул или атомов, между которыми есть межатомные расстояния. Молекула является наименьшей частицей вещества, обладающая его основными свойствами. Вещества, молекулы которых состоят из одного атома, находятся в атомарном состоянии, а из двух и более атомов - в молекулярном.
Например, гелий (Не) состоит из отдельных атомов, а молекула кислорода (О2) – из двух атомов.
Число атомов в молекуле может достигать десятки частиц.Если два тела состоят из одного и того же числа атомов, то эти тела содержат одинаковое количество вещества.
Обозначается количество вещества греческой буквой ν (ню), единицы измерения в системе СИ являются моль.
Один моль – это количества вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.

В 0,012 кг углерода содержится 6 · 1023 атомов.
Это число называют постоянной Авогадро в честь итальянского учёного.
В 1811 году Амедео Авогадро установил один из газовых законов, названный его именем. Согласно этому закону в одинаковых объемах газов при одинаковых значениях температуры и давления содержится одинаковое количество молекул.
Количество вещества равно отношению числа молекул N в данном теле к постоянной Авогадро NА , т.е. к числу молекул в 1 моле вещества.

Количества вещества можно выразить через молярную массу (М).
Количества вещества равно отношению массы вещества к его молярной массе

Молярная масса (М) – это масса одного моля вещества.
Рассмотрим пример определения количества вещества капельки воды массой 9·10–3 кг. Для решения этой задачи необходимо найти молярную массу воды.
Наиболее удобный способ определения молярной массы через относительную молекулярную массу.
Относительной молекулярной (или атомной) массой (Мr) вещества называют отношение массы одной молекулы (или атома) m0 данного вещества к 1/12 массы атома углерода m0c.
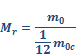
На практике относительную молекулярную массу находят по периодической системе химических элементов.
В таблице указаны относительные атомные массы элементов.
Складывая их в соответствии с химической формулой, получают Мr.
В нашем случае для молекулы воды имеем:
![]()
Молярная масса находится по формуле:
![]()
Молярная масса для молекулы воды:
![]()
Теперь можно подсчитать количества вещества:

Зная количества вещества, найдём число молекул, содержащееся в капле воды массой
![]()
![]()
Также можно найти массу молекулы воды:
![]()
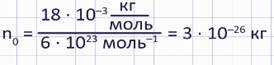
И так для определения массы одной молекулы или атома вещества можно использовать формулу:
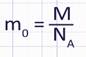
Диаметр молекулы воды можно вычислить следующим образом:
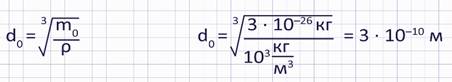
Рассмотрим пример решения следующей задачи:
Чему равно количества вещества, и какую массу имеют 12·1023 молекул углекислого газа?
Запишем задачу в соответствии с оформлением физических задач:

При решении задач обратите внимание на единицы измерения, которые должны быть выражены в системе СИ.
Рассмотрим следующий пример:
Какова толщина плёнки масла на поверхности воды, если капля масла массой 16 ·10–4г образовало пятно площадью 1,1 м2?
Чему равен диаметр молекулы масла?
Плотность масла считать 900 кг/м3.

Каждая задача требует особый подход к решению.
Это видно из решения предыдущей задачи.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!