
Изделия из металлов и их сплавов, кроме золота и платины, под действием воздуха, влаги постепенно разрушаются в результате химических реакций, протекающих между металлами и веществами, содержащимися в окружающей среде. Особенно сильное разрушительное действие на металлы оказывает кислород, растворенный в воде.
Процесс самопроизвольного разрушения металлов под влиянием окружающей среды называют коррозией.
Коррозия металлов наносит огромный вред экономике. Человечество несет большие убытки в результате коррозии трубопроводов, деталей машин, судов, мостов, технологического оборудования. Установлено, что потери металла от коррозии в мире уже составляют около 30% от его годового производства. Считается, что 10% прокоррозировавшего металла теряется (в основном в виде ржавчины) безвозвратно.
Коррозия металлов – это окислительно-восстановительный процесс, при котором атомы металла окисляются и переходят в ионы. Схему этого процесса можно изобразить так: М0 – ne– = Mn+
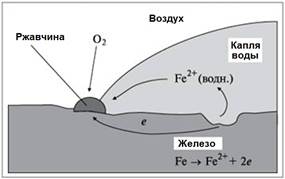
Коррозии подвергаются различные металлы и сплавы, но наиболее часто корродирует железо и его различные сплавы. В общем виде процесс коррозии железа и его сплавов можно изобразить так:
Fe0 – 2e– = Fe2+
Fe2+ – e– = Fe3+
В качестве окислителя обычно выступает кислород О2, а также ионы водорода H+ , образующиеся при диссоциации молекул воды и растворенных в воде оксида углерода (IV), оксида серы(IV), сероводорода и других соединений.
Химическая коррозия металлов – это разрушение металлов в результате их взаимодействия с веществами окружающей среды.

Наиболее распространенным видом химической коррозии является газовая коррозия. Она протекает в сухих газах при полном отсутствии влаги. Газы окружающей среды реагируют с металлом на поверхности изделия и образуют с ним соединения. Если образующийся продукт взаимодействия нелетучий и образует плотную пленку, как у алюминия, то коррозия постепенно уменьшается и может совсем прекратиться. Если же образуется рыхлая пленка (как ржавчина железа), то коррозия может привести к полному разрушению металла.
Электрохимическая коррозия – это разрушение металлов, которое сопровождается возникновением электрического тока. В результате данного вида коррозии вместе с химическими процессами протекают электрические процессы (перенос электронов от одного участка изделия к другому).
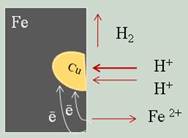
Если два разных металла, находящиеся в контакте между собой, опустить в водный раствор электролита, то более активный металл, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, предохраняя менее активный металл от коррозии.
Например, при контакте железа с медью в водной среде более активное железо постепенно корродирует, переходя в воду в виде ионов железа. Электроны, высвободившиеся из атомов железа, перейдут к меди и на ее поверхности соединятся с ионами водорода, выделившимися из компонентов водной среды.
Этот электрохимический процесс можно представить так:
на железе Fe0 – 2e– = Fe2+
на меди 2H+ +2e– = H20
в ионном виде Fe0 + 2H+ = Fe2++ H20

При контакте железа с более активным металлом (цинком, алюминием, магнием) они разрушаются, защищая железо от коррозии.
Изучение сущности процессов коррозии помогает предвидеть методы борьбы с этим нежеланным явлением.
Для борьбы с коррозией существует много способов, рассмотрим некоторые из них.
Первый способ – нанесение защитных покрытий на поверхности корродирующего металла. Для этого часто используют масляные краски, эмали, лаки или покрывают металл слоем другого металла (золота, серебра, хрома, никеля, олова, цинка).
Например, для сохранения от коррозии знаменитой Эйфелевой башни в Париже, которая состоит из 18 000 металлических элементов и весит 7 300 тонн, используют покраску. Этот процесс занимает 18 месяцев и осуществляется командой из 25 высококвалифицированных рабочих. Всё сооружение окрашивается в два слоя. При этом расходуется около 60 тонн краски. Покраску осуществляют каждые 7 лет.
Для защиты изделия от коррозии их покрывают цинком, кадмием, оловом, свинцом, никелем, кобальтом.
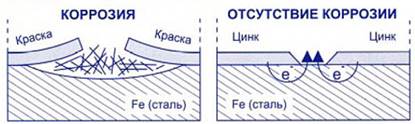
Например, никелевые покрытия нарядны, стойки, прочны. Ежегодно во всем мире никелируют миллионы квадратных метров поверхности различных изделий – от дверных ручек до бамперов автомобилей. Один из самых старых способов – это лужение или покрытие железного листа оловом. Лужению подвергают изделия, идущие для приготовления и хранения пищи (кастрюли, ведра, тазы, молочные бидоны, консервные банки, пастеризационные аппараты, части сепараторов и тому подобные).
Второй способ – получение сплавов, стойких к коррозии. Чтобы увеличить коррозионную стойкость сплавов железа, в их состав добавляют хром или никель, такие стали называют нержавеющие стали. Сплавы, содержащие более 12-14% хрома, ведут себя как благородные металлы: они не ржавеют и не окисляются на воздухе, в воде, в ряде кислот, солей и щелочей. В медицине для изготовления каркаса зубов используют кобальтохромовый сплав или никельхромовый сплав.
Третий способ – изменение состава среды. В среду, окружающую металлы, вводят специальные вещества, которые в десятки или сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии. Ингибиторы вводят в нефтепроводы, в замкнутые системы охлаждения, для снижения коррозии труб.
Четвертый способ – электрохимический метод защиты. При использовании этого метода создают контакт с более активным металлом – протектором. Например, для защиты стальных корпусов морских судов или сооружений мостов используют цинк, который приваривают к конструкции.
Коррозией называют процесс самопроизвольного разрушения металлов под влиянием окружающей среды. В процессе коррозии атомы металла окисляются и переходят в ионы. Выделяют химическую и электрохимическую коррозию. Для борьбы с коррозией применяют следующие способы: нанесение защитных покрытий на поверхности металла, получение сплавов, стойких к коррозии, изменение состава среды, электрохимический метод защиты. Коррозия металлов наносит большой экономический вред.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!