Все тела состоят из частиц: атомов и молекул. Оказывается, что в состав атома входят еще частицы. Выясним, что это за частицы и для чего нужно знать строение атома.
Изучением строения атома занимались такие известные люди, как Демокрит, Томсон и Резерфорд.
В1897 году была предложена модель атома Томсона.
Модель строения атома Дж. Томсона.
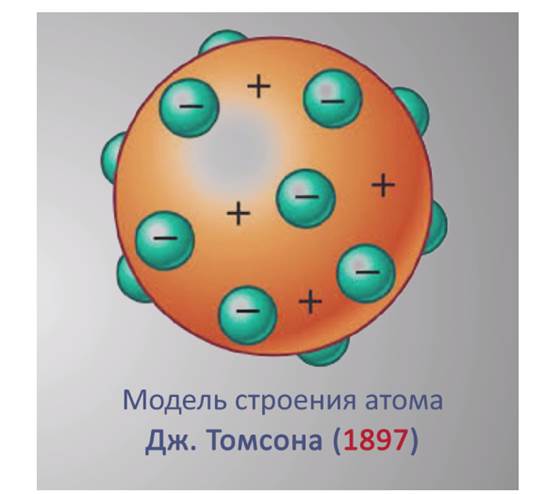
Английский физик Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны. Эту модель образно называют «сливовый пудинг» или «арбуз» с «семечками» – электронами. Эта модель оказалось отклонена от экспериментальных данных.
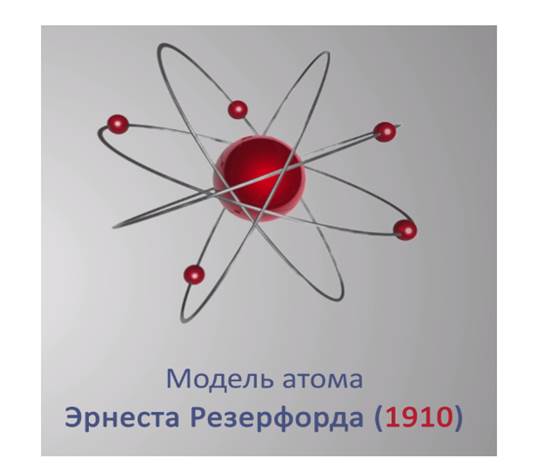
В 1910 году английский физик Эрнст Резерфорд со своими учениками провели эксперимент, который дал поразительные результаты.
Эрнст Резерфорд доказал на опыте по рассеянию альфа-частиц, что в центре атома имеется положительно заряженное ядро, вокруг которого, подобно планетам вокруг Солнца, вращаются электроны, поэтому модель атома прозвали планетарной.
В центре атома имеется ядро, внутри ядра – протоныи нейтроны.
Вокруг ядра быстро вращаются электроны, образуя электронные облака.
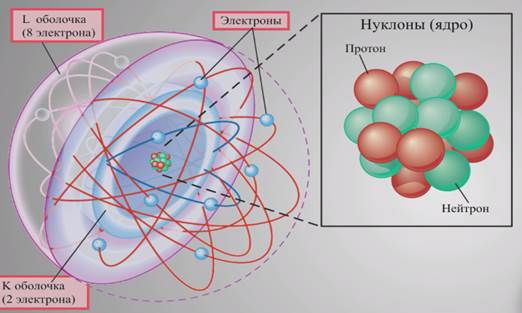
Количество протонов в ядре атома равно количеству электронов, движущихся вокруг него. Количество нейтронов может быть разным. Протоны и нейтроны составляют ядро атома и называются нуклонами (nucleus – ядро). Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). По массе протон приблизительно равен массе нейтрона, а масса электрона мала по сравнению их массами.
Для образования нового атома или получения энергии в результате их деления или распада необходимо знать количество протонов, электронов и нейтронов в атоме. Для этого ввели обозначения: массовое число обозначается буквой А
(сумма протонов и нейтронов), данное число выписываем из таблицы Менделеева с округлением, число протонов, соответствующее порядковому номеру атома в периодической системе Менделеева – Z, и определяет его принадлежность к некоторому химическому элементу, а число нейтронов
N – определённому изотопу этого элемента.
Изото́пы – это химические элементы, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа.
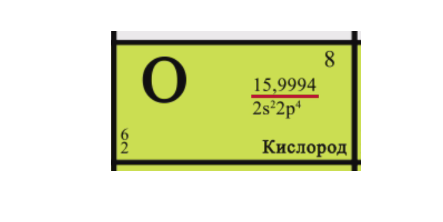
Пример изотопов: 168O, 178O, 188O – три стабильных изотопа кислорода.
Чтобы узнать число нейтронов, достаточно знать массовое число. Или его называют число нуклонов и число протонов, то есть
N = A – Z
Выберем из таблицы Д.И. Менделеева элемент – сера. Выпишем из нее число протонов и нуклонов. Обратите внимание, как правильно записывают элемент с набором чисел.
![]()
Слева нижний индекс элемента обозначает число нуклонов, а верхний – число протонов в ядре атома.
Согласно данным таблицы видно, что Z = 16, число нуклонов А = 32. Легко вычислить число нейтронов по формуле:
N = A – Z = 32 – 16 = 16
![]()
В состав ядра атома серы входят: 16 протонов, расположенных внутри ядра атома, и не забываем, что 16 электронов, вращающихся вокруг ядра, число нейтронов равно 16, а число нуклонов в ядре атома – 32.
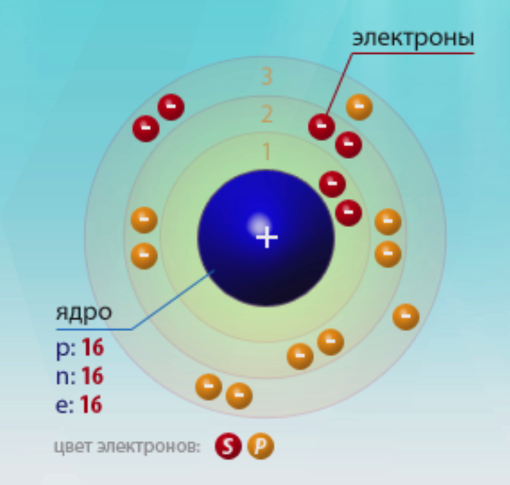
Частицы ядра прочно связаны друг с другом особыми ядерными силами. Именно поэтому и модель атома еще прозвали ядерной. Так как притяжение электронов к ядру гораздо слабее, чем притяжение протонов и нейтронов, поэтому электроны могут отделяться от своих атомов и переходить к другим. При переходе электронов образуются ионы – атомы или группы атомов, в которых число электронов не равно числу протонов.
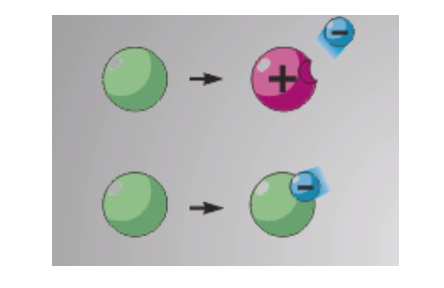
Если ион содержит отрицательно заряженных частиц больше, чем положительно заряженных, то такой ион называют отрицательным. В противоположном случае ион называют положительным.
В верхней части рисунка показана потеря атомом электрона, то есть образование положительного иона. В нижней части рисунка – образование из атома отрицательного иона, то есть присоединение электрона. В результате повышения температуры окружающей среды возникают колебательные движения частиц внутри атома, которые приводят к отрыву отрицательных частиц. Появления ионов является увеличенное колебание частиц в кристаллической решетке.
·Планетарная и ядерная модель строение атома была открыта на основе экспериментов в 1910 году Эрнестом Резерфордом. Согласно этой модели:
·Атом электрически нейтрален.
·Внутри атома находится ядро.
·Внутри ядра атома расположены нуклоны.
·Вокруг ядра атома вращаются электроны, как планеты солнечной системы.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!