Вода – важнейшее вещество среди многочисленных соединений водорода. Это самое распространенное на Земле вещество. Гидросфера – водная оболочка планеты – занимает 71% поверхности. Вода входит в состав минералов, горных пород, всех живых организмов.
Мы познакомились с водой как растворителем, способами ее синтеза и разложения, отдельными химическими свойствами. Обобщим и расширим эти знания.
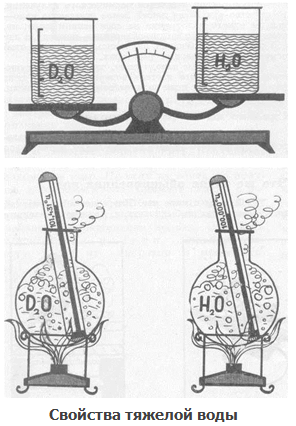
В связи с существованием изотопов водорода (Н, D, Т) и кислорода (16О, 17О, 18О) известно несколько изотопных разновидностей воды. Особый интерес представляет тяжелая водаD2О, впервые выделенная из природной воды в 1932 году. Присутствие в составе молекул атомов дейтерия существенно сказывается на свойствах вещества. Последние в значительной степени отличаются от свойств обыкновенной воды. Так, у тяжёлой воды температура кипения составляет 101,43°С, температура плавления равна 3,82°С, плотность равна 1,104 г/см3. У обычной воды эти величины соответственно равны 100°С, 0°С и 0,9982 г/см3. На живые организмы даже небольшие количества тяжёлой воды действуют угнетающе.
По химическим свойствам тяжелая вода близка к обычной. Разговор об изотопах водорода будет неполным без упоминания тяжелой воды D2О, т. е. воды, в состав которой вместо протия входят атомы дейтерия. Это вещество нашло применение в качестве замедлителя нейтронов в ядерных реакторах. Количество природной тяжелой воды невелико – 0,02 % от общей массы воды. Собранная со всего земного шара, она могла бы наполнить водоем, равный по объему Черному морю.
В составе вод Земли содержится и сверхтяжелая вода, имеющая в своем составе тритий. Этого экзотического вещества на планете всего 13-20 кг.
Молярные массы газов – углекислого, сероводорода соответственно равны 44 и 34 г/моль, а молярная масса воды – 18 г/моль.
Как объяснить, что более легкие молекулы воды образуют жидкость, в то время как более тяжелые молекулы сероводорода при нормальных условиях существуют в газообразном состоянии?
По всей видимости, ответ следует искать в строении вещества. Мы уже знакомы с образованием и строением молекулы воды.
Обе связи О-Н в молекуле воды – ковалентные, полярные, равноценные. В то же время заряды в молекуле воды распределяются таким образом, что формируются две противоположно заряженные области, которые находятся на некотором расстоянии друг от друга.
Угловое строение молекулы воды, а также наличие в ней противоположно заряженных центров приводят к возникновению так называемых водородных связей (на рис. 1 эти связи показаны пунктиром).
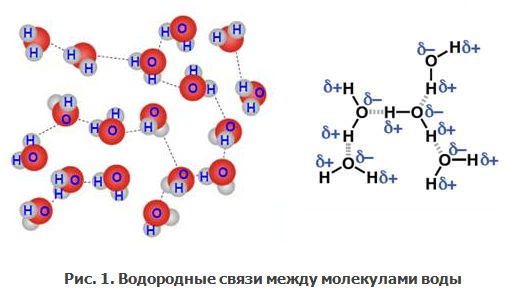
Отрицательно заряженный атом кислорода одной молекулы притягивается к положительно заряженному атому водорода другой молекулы, и наоборот. Таким образом, возникает межмолекулярное взаимодействие. Молекулы воды оказываются ассоциированными (объединенными) посредством водородных связей. В единый комплекс объединяется по 5-7 молекул воды. Такое объединение ведет к укрупнению частиц вещества, что и обусловливает физические свойства воды.
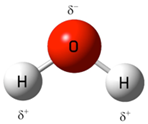
Итак, молекула воды полярна (диполь). Этим объясняется ее универсальная способность к растворению всех веществ, имеющих полярное строение.
Мы уже вспоминали, что во времена алхимии было сформулировано «золотое правило» растворения: подобное растворяется в подобном. Вода блестяще подтверждает это правило: в ней растворяются оксиды, кислоты, соли, щелочи — вещества, для которых характерна ионная или полярная ковалентная связь.
Вода – химически активное вещество.
Взаимодействие воды с металлами. Эти реакции относятся к окислительно-восстановительным. При комнатной температуре с водой реагируют лишь наиболее активные - щелочные и щёлочноземельные, металлы, относящиеся к главным подгруппам I и II групп периодической системы. В результате образуется щелочь и выделяется водород.
2Na + 2H2O→ 2NaOH + H2↑, Ca + 2H2O→Ca(OH)2 + H2↑.
Эти реакции протекают очень бурно, сопровождаются выделением большого количества тепла.
При нагревании в реакцию с водой вступают магний и цинк.
Zn + H2O → ZnO + H2↑.
Алюминий будет взаимодействовать только после удаления с его поверхности оксидной пленки.
2Al + 3H2O → Al2O3 + 3H2↑.
Железо вступает в реакцию с водой только при температуре красного каления.
3Fe + 4H2O → Fe3O4 + 4H2↑.
Вода взаимодействует с растворимыми кислотными оксидами с образованием соответствующих кислот.
При взаимодействии оксида серы (VI) с водой образуется серная кислота:
SO3 + H2O → H2SO4.
Вода взаимодействует с оксидами щелочных и щелочноземельных металлов с образованием растворимых или малорастворимых в воде оснований.
При взаимодействии с водой оксида натрия образуется гидроксид натрия:
Na2O + H2O → 2NaOH.
При взаимодействии с водой оксида кальция образуется гидроксид кальция:
СaO + H2O → Сa(OH)2.
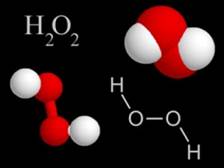
Помимо воды, существует еще одно кислородное соединение водорода. Это пероксид (или перекись) водорода.
Состав вещества выражается формулой Н2О2. Структурная формула его отличается от структурной формулы воды: Н-О-О-Н. Степень окисления кислорода в пероксиде водорода -1.
В лаборатории обычно используют 3%-й и 30%-й (последний называется пергидролем) растворы пероксида водорода.
Пероксид водорода – очень непрочное химическое соединение. Оно способно разлагаться со взрывом. В результате реакции образуются вода и кислород:
2Н2О2→ 2Н2О + О2.
Пероксид водорода – сильный окислитель. Он используется для отбеливания мехов и тканей, в сельском хозяйстве находит применение для протравливания семян с целью их дезинфекции. В медицине 3%-й раствор пероксида водорода используют в качестве дезинфицирующего средства. В качестве сильного окислителя Н2О2 применяют в ракетной технике.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!