В ходе наблюдений и опытов мы познакомились со многими веществами. Мы узнали, что все вещества состоят из связанных между собой атомов.
Атом – мельчайшая частица химического элемента, наименьшая часть простых и сложных веществ.
Способность атомов образовывать разные химические соединения зависит от их состава и строения. Поэтому необходимо изучить атомы, познать их внутреннюю, невидимую простым глазом природу, чтобы объяснить образование и изменения веществ. Важной предпосылкой для изучения состава и строения атома было открытие явления радиоактивности.

В 1896 году французский ученый Антуан Анри Беккерель обнаружил, что атомы химического элемента урана испускают α-излучение наподобие рентгеновского. В 1898 году Мария Склодовская-Кюри получила из урановой руды два новых радиоактивных металла – полоний и радий. Совместно с Пьером Кюри она установила, что атомы этих металлов выделяют такие же лучи, как и уран, но более интенсивно. В 1900 году Пьер Кюри открыл γ-излучение. Уран, полоний и радий были названы радиоактивными элементами, а само явление излучения – радиоактивностью.
Радиоактивность – это свойство атомов некоторых элементов произвольно излучать невидимые глазом частицы, оно обусловлено распадом их атомных ядер, превращением в другие элементы.
Этот распад сопровождается излучением трёх видов:α, β и γ.
ядро электроны
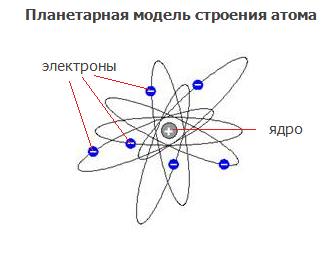
Используя α-излучение (поток ядер гелия, обладающих большой скоростью, имеющих массу 4 и заряд +2) и испытывая его действие на тонкую металлическую фольгу бериллия, английский ученый Эрнест Резерфорд обнаружил, что α-частицы, проходя через нее, отклоняются от первоначального направления движения. Это открытие послужило экспериментальным доказательством существования положительно заряженного ядра атома.
На его основе в 1911 году ученый предсказал наличие в ядре атома положительно заряженной частицы – протона и создал планетарную модель атома.
Согласно планетарной модели атом состоит изнесущего положительный заряд ядра и движущихся вокруг него отрицательно заряженных частиц – электронов.

В 1932 году Джеймс Чедвик открыл нейтрон, а еще позднее было выявлено огромное число разнообразных микрочастиц, входящих в состав протона.
В современной науке основными элементарными частицами атома признаны протон, нейтрон, электрон. Остановимся подробнее на составе атома и характеристике этих частиц.
Атом состоит из ядра и электронов.Ядро – это часть атома, состоящая из протонов и нейтронов и имеющая положительный заряд. Масса атома определяется массой его протонов и нейтронов.
По своей массе протоны и нейтроны почти одинаковы: 1,673 × 10-24 г и 1,675 × 10-24г. Пользоваться массой таких маленьких частиц в граммах очень неудобно, поэтому введено понятие относительной атомной массы. Сравнивая массы протона и нейтрона с одной углеродной единицей, которая равна 1,661 × 10-24г, получаем простые целые числа – масса протона равна 1, масса нейтрона равна 1.
Протон имеет положительный заряд, равный +1, а нейтрон заряда не имеет.
Электрон имеет наименьший заряд (1,6 × 10-19Кл), который условно принят за единицу,
т.е. – 1. Массой электронов по сравнению с массой ядра можно практически пренебречь (масса протона более чем в 1800 раз превышает массу электрона). Обобщим вышесказанное в виде следующих определений.
Протоны – это элементарные частицы с массой, приблизительно равной 1, и зарядом +1.
Нейтроны – это электронейтральные (незаряженные) частицы ядра атома с массой, равной 1.
Электроны – это отрицательно заряженные частицы атома, расположенные вокруг ядра атома. Они образуют электронную оболочку атома.
Разновидности атомных ядер с определённым числом протонов и нейтронов называются нуклидами.
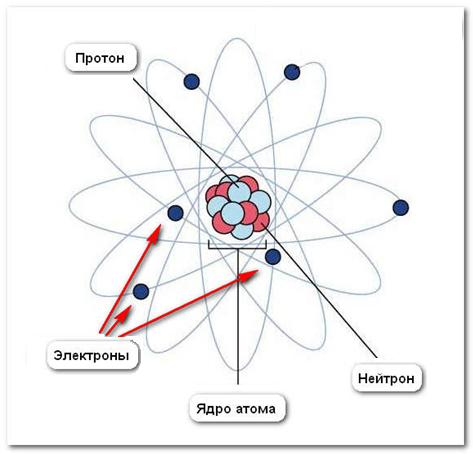
Согласно современной теории ядра, протоны и нейтроны, входящие в состав ядра, связаны между собой чрезвычайно большими ядерными силами. Ядро по своим размерам весьма компактно. Оно в 100 000 раз меньше самого атома, но отличается большой плотностью. В нём сосредоточена почти вся масса атома.
Составляющие атом частицы обусловливают его важнейшие характеристики. С некоторыми из них мы уже знакомы (валентность, масса и другие).
Заряд ядра – важнейшая характеристика атома и соответствующего ему химического элемента, лежащая в основе его современного определения. Положительный заряд ядра создают его протоны: заряд ядра равен числу протонов в нем. Порядковый (атомный) номер элемента в периодической системе равен заряду ядра его атомов и обозначается буквой Z. Следовательно, заряд ядра является также важнейшей характеристикой химического элемента.
Таким образом,
химический элемент – это вид атомов с одинаковым зарядом ядра.
Другой характеристикой атома, зависимой от протонов и нейтронов ядра, является масса ядра. Она обозначается буквой А и называется массовым числом.
Массовое число – это сумма числа протонов и нейтронов в ядре атома.
Обе характеристики используются для индексации атома: они ставятся слева от символа элемента, где А – верхний индекс, а Z – нижний индекс, например: 126С.
Протоны и нейтроны определяют количественные характеристики атомов. От электронов атома зависят его качественные характеристики – способность объединяться с другими атомами, химические свойства.
Обратимся к периодической системе химических элементов Д. И. Менделеева.
Мы видим, что числа, выражающие атомные массы элементов, имеют дробные значения, а при закономерном линейном увеличении атомных масс химических элементов имеет место некоторое «нарушение» закономерности.
Возникает вопрос, почему в парах элементов аргон – калий, кобальт – никель, теллур – йод впереди стоящий элемент имеет большую атомную массу, чем последующий, почему атомные массы элементов обозначены дробными числами, если массы протонов и нейтронов приняты за 1, а массой электронов как ничтожной можно пренебречь? Какова причина кажущихся «нарушений»?
Ответы дают экспериментальные и теоретические исследования состава ядер и масс атомов различными методами. Они показали, что в ядрах атомов одного и того же элемента всегда имеется одинаковое число протонов, но может содержаться разное число нейтронов. Такие атомы отличаются друг от друга разным массовым числом и некоторыми свойствами (например, разной скоростью диффузии). Так, например, в составе элемента углерода имеются атомы с числом нейтронов 6, 7, 8. Но все они относятся к одному элементу – углероду, поскольку заряд ядра у них одинаков: +6.
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную атомную массу, называются изотопами.
Термин происходит от греческого isos – «равный», topos — «место», т. е. занимающие одно и то же место в периодической системе.

В большинстве случаев в природе каждый элемент представляет собой совокупность разных его изотопов. Содержание каждого изотопа в элементе обычно выражают в процентах. Например, природный кислород состоит из трёх изотопов: 16О, его изотопное содержание 99,76%, 17О – его 0,04%, и 18О – его 0,2%.
Относительная атомная масса химического элемента равна среднему значению масс всех его природных изотопов с учётом их распространённости. В качестве стандарта для определения относительной атомной массы принимается 1/12 массы изотопа атома углерода 12С.
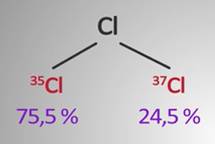
Например, хлор имеет два изотопа: 35С1 – его содержание составляет 75,5 %, и 37С1 – его 24,5 %.
Относительная атомная масса хлора равна 35 × 0,755 + 37 × 0,245 = 35,459 = 35,5.
Эту же величину мы видим в периодической таблице.
Явление изотопии позволяет объяснить причину некоторых «нарушений» в последовательном увеличении значений атомных масс элементов в уже упоминавшихся ранее парах: аргон – калий, кобальт – никель, теллур – йод.
Содержание самого легкого изотопа калия 39К составляет 93 %, это выше, чем более содержание тяжелых изотопов 40К и 41К. Поэтому среднее значение относительной молекулярной массы калия равно 39,102. У аргона, наоборот, преобладает содержание тяжёлого изотопа 40Ar, его около 99 %. Относительная атомная масса аргона составляет 39,948. Отсюда у аргона, элемента с порядковым номером 18, относительная атомная масса больше, чем у элемента с порядковым номером 19. Подобным образом объясняются и другие отклонения в изменении масс элементов в периодической системе.
Изотопы известны для всех химических элементов. Наибольшее число изотопов имеют элементы с порядковым номером 2, от 40 до 56.
Теория строения ядра и явление изотопии позволяют уточнить понятие об относительной атомной массе элемента, углубить знания об элементе и дать ему более современные определения. Химический элемент – это вид атомов с одинаковым зарядом ядра. Химический элемент – это совокупность его изотопов.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!