Атомы химических элементов – это те «кирпичики», из которых построено всё вещество Вселенной.
К 60-м годам XIX века, ознаменовавшимся утверждением и распространением в естествознании идей атомно-молекулярного учения, было открыто 64 элемента. Для дальнейшего развития науки возникла необходимость систематизировать их, найти общие закономерности и ответить на вопросы: много ли химических элементов ещё не найдено? В каких направлениях следует вести их поиск?
Для систематизации химических элементов необходимо было вначале классифицировать их. Одной из первых классификаций являлось распределение элементов на металлы и неметаллы по общим физическим свойствам. Делались попытки объединить элементы по сходству их свойств в отдельные группы, семейства и даже найти общие закономерности, характерные для уже сгруппированных элементов.
Каждый химический элемент весьма индивидуален по своей природе, но в то же время у отдельных элементов имеются сходные признаки.

Основываясь на них, немецкий учёный Иоганн Вольфганг Дёберейнер объединил сходные между собой элементы в триады, например: галогены (хлор, бром и йод); щёлочноземельные металлы (кальций, стронций, барий). Аналогичные по свойствам и характерным признакам элементы были сгруппированы в естественные семейства.
В середине XIX века продолжился поиск такой характеристики элементов, в зависимости от которой находились бы все остальные их свойства.

Английский учёный Джон Ньюлендс обнаружил, что при расположении элементов в порядке увеличения атомного веса, их свойства повторяются через каждые семь элементов. На основе замеченной периодичности в изменении свойств он выделил октавы элементов, в которых каждый восьмой элемент имел сходство с первым элементом предшествующей группы.
Французский учёный Александр де Шанкуртуа расположил известные в то время химические элементы по спирали с увеличением их атомного веса.

В полученной спирали одни элементы располагались под другими таким образом, что удалось установить сходство некоторых из них по вертикали.
Немецкий исследователь Виктор Мейер расположил сходные элементы в вертикальные столбцы и получил таблицу элементов.

Он ближе всех подошёл к открытию закона периодичности, но не сумел сделать нужные теоретические обобщения.
Безуспешность поиска общего закона, который позволил бы свести все элементы в единую систему, объяснялась тем, что учёные устанавливали и анализировали закономерности изменения свойств элементов лишь в сходных группах. Они не пытались сопоставлять все известные элементы между собой, сравнивать друг с другом противоположные по свойствам группы. Вместе с тем в этих научных поисках прослеживалась определённая логика развития науки: от накопления и анализа фактов к их систематизации, а затем к выявлению закономерностей.
Создать универсальную систему химических элементов удалось нашему великому соотечественнику Дмитрию Ивановичу Менделееву в 1869 году.
В отличие от своих предшественников, Менделеев сравнивал не только сходные, но главным образом несходные между собой элементы и их группы (например, щелочные металлы и галогены), располагая их на основе главной (известной к тому времени) характеристики элемента – атомного веса
В отличие от своих предшественников, Менделеев сравнивал не только сходные, но главным образом несходные между собой элементы и их группы (например, щелочные металлы и галогены), располагая их на основе главной (известной к тому времени) характеристики элемента – атомного веса.

Менделеев сопоставил элементы разных групп, располагая их в порядке возрастания атомных весов: фтор –19, натрий – 23, магний – 24; хлор – 35,5, калий – 39,
кальций – 40; бром – 80, рубидий – 85, стронций – 88.
В этих трёх группах видна суть дела», – писал Менделеев. Галогены обладают меньшим атомным весом, чем щелочные металлы, а они – меньшим, чем щёлочноземельные металлы.

При этом в непрерывном ряду элементов: F, Nа, Mg, ..., Cl, K, Ca, ..., Br, Rb, Sr, ... несмотря на пропуски многих из них, видно, что свойства элементов меняются периодически, т. е. резкий переход от металла к неметаллу сменяется плавным переходом от щелочного металла к щёлочноземельному и уменьшению основных свойств их соединений.
На основе всестороннего и глубокого анализа, сравнения, синтеза и обобщения всех накопленных знаний об элементах, а также благодаря гениальной научной интуиции Дмитрий Иванович Менделеев открыл в 1869 году периодический закон.
Благодаря его открытию все известные сегодня химические элементы объединены в единую систему. Слово «система» говорит о том, что элементы размещаются в ней согласно определённому закону и изменять в ней что-либо произвольно нельзя. Действительно, система химических элементов обобщенно выражает периодический закон. Менделеев открыл этот закон на основании накопленных фактов и огромной аналитической работы, в ходе которой были найдены закономерности периодического повторения свойств элементов, рассмотренных в порядке возрастания значений их атомного веса. Атомным весом тогда называли относительную атомную массу элемента.
Формулировка закона в то время была такова:
Свойства химических элементов, а также свойства и формы их соединений находятся в периодической зависимости от их атомных весов.
Затем на основании этого закона учёный расположил все известные химические элементы в определённой последовательности, создав тем самым периодическую систему. Сложность работы заключалась в том, что к 1869 году были известны далеко не все элементы, а атомная масса многих из них была определена неточно.
Чтобы составить такой ряд элементов, в котором их атомная масса действительно постоянно, монотонно возрастала, учёному пришлось уточнить значения атомного веса и свойства ряда элементов.
В этом ряду Менделеев смог выделить последовательно располагающиеся отрезки, на протяжении которых повторялся характер изменения свойств элементов от металлических к неметаллическим. На этом основании он разделил ряд элементов на периоды.
Периодом называется такой ряд элементов, в котором атомная масса постепенно возрастает, а свойства элементов изменяются от металлических к неметаллическим. Каждый период начинается с типичного металла и заканчивается типичным неметаллом.
Периоды Д.И. Менделеев разместил один под другим так, чтобы элементы со сходными свойствами оказывались в одном вертикальном столбце (металлы – под металлами, неметаллы – под неметаллами), составляющем группу.
Получилась таблица, в которой место каждого химического элемента определено двумя параметрами – номером периода и номером группы.
Открывались большие возможности применения периодического закона. Используя их, учёный не только исправил характеристики некоторых известных элементов, но и предсказал существование новых элементов, которые ещё не были открыты, например элементов, расположенных за кальцием, цинком и др.
Д.И. Менделеев не только предсказал, но и с большой точностью описал элементы, которые назвал экаалюминием, экабором, экасилицием (стоящие ниже алюминия, бора, кремния).
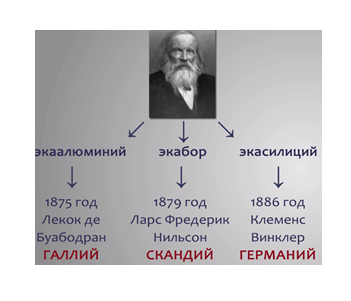
Учёные всего мира с нетерпением ждали открытия этих элементов. В 1875 году француз Лекок де Буабодран открыл предсказанный Менделеевым элемент «экаалюминий» и назвал в честь своей родины галлием (старинное название Франции – Галлия). В 1879 году Ларс Фредерик Нильсон обнаружил и назвал скандием описанный Менделеевым элемент «экабор». В 1886 году Клеменс Винклер открыл третий предсказанный элемент «экасилиций» и также назвал его в честь родины германием. Учёных поразила необыкновенная точность, с которой эти неизвестные ещё элементы были описаны Менделеевым.
После этих открытий на основе периодического закона стали прогнозировать открытие новых элементов и уточнять свойства имеющихся.
Открытие группы инертных элементов, или, как их ещё называют, «благородных газов», расширило периодическую систему. Позже Менделеев использовал введённую им более фундаментальную, чем атомный вес, характеристику элементов, а именно их порядковый номер (физический смысл порядкового номера объяснили позднее). Были установлены закономерности изменения свойств элементов в периодах и группах. Шли поиски удобного табличного выражения периодической системы как естественной классификации элементов.
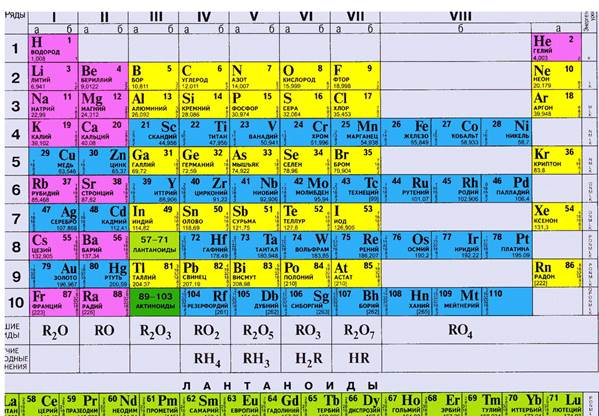
Современный вариант периодической таблицы выглядит так.
Каждая группа элементов (вертикальный столбец) состоит из двух подгрупп: главной (А-группы) и побочной (В-группы).
А-группы составляют элементы с 1-го по 7-й период. В-группы образованы элементами периодов с 4-го по 7-й период.
Место каждого химического элемента в системе определено его свойствами, рассмотренными в сопоставлении со свойствами всех химических элементов. Поэтому порядковый номер элемента (обозначается буквой Z) является существенной характеристикой каждого элемента.
Научимся характеризовать место элементов в периодической системе.
Кислород.
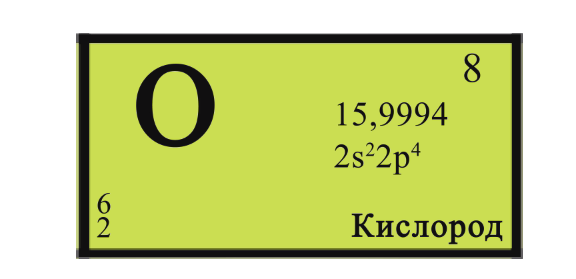
Порядковый номер Z(О) = 8. Элемент 2-го периода VIА-группы периодической системы. Неметалл. Ar(O) = 16
Кальций. Порядковый номер Z(Са) = 20. Элемент 4-го периода IIА-группы периодической системы. Металл. Ar(Ca) = 40.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!