Химические элементы редко встречаются в природе в виде одиночных атомов. Например, в космическом пространстве существует в виде отдельных атомов водород. В условиях же Земли более естественной и распространённой формой существования химических элементов являются химические вещества – простые и сложные.
Химические вещества, образованные атомами одного химического элемента, называют ПРОСТЫМИ ВЕЩЕСТВАМИ.

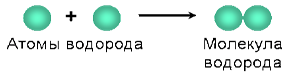
Например, вещество водород состоит из молекул, образованных атомами химического элемента водорода, вещество кислород – из молекул, состоящих из атомов химического элемента кислорода, а вещество углерод (алмаз или графит), имеющее немолекулярную структуру, состоит из атомов углерода, соединенных между собой по-разному.
Химические вещества, образованные атомами разных химических элементов, называют СЛОЖНЫМИ ВЕЩЕСТВАМИ.
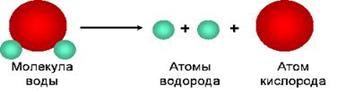
Например, вещество вода состоит из молекул, образованных атомами химических элементов водорода и кислорода.
Сложное вещество, состоящее из химически связанных атомов двух или более элементов, называется ХИМИЧЕСКИМ СОЕДИНЕНИЕМ.
Таким образом, можно выделить три формы существования химических элементов: в виде одиночных атомов, в составе простых веществ и в составе сложных веществ.
Простые вещества, как и образующие их элементы, делятся на металлы и неметаллы. Определить, к какому классу относится простое вещество, можно по периодической системе химических элементов. Элементы подгрупп А, т.е. главных подгрупп, разделяются на металлы и неметаллы по диагонали от бора к астату, причем металлы будут находится в нижней левой, а неметаллы в правой верхней части. Элементы подгрупп В, т.е. побочных подгрупп, проявляют переходные свойства, но простые вещества, ими образованные, являются металлами.
Простые вещества металлы образованы атомами химических элементов металлов. Они характеризуются наличием металлического блеска, являются хорошими проводниками тепла и электрического тока, ковкие и пластичные. Например, алюминий сохраняет металлический блеск даже в порошке. Его высокая электропроводность позволяет изготавливать из него электрические провода. Алюминиевая ложка в чае нагревается почти мгновенно. Из алюминия можно изготовить проволоку и фольгу толщиной около одной сотой миллиметра.
Простые вещества неметаллы образованы атомами химических элементов неметаллов. Они не имеют металлического блеска, плохо проводят тепло и электрический ток, в твердом состоянии хрупкие и непластичные. Простое вещество сера встречается в природе в виде хрупких грязно-желтых самородков, которые не проводят тепла и электрического тока.
Русские названия простых веществ обычно совпадают с русскими названиями соответствующих химических элементов: водород – водород, медь – медь и т.д. Но есть и исключения. Например, атомы элемента углерода образуют несколько простых веществ (аллотропных модификаций) – сажу, алмаз, графит, различных по строению и свойствам. Атомы элемента кислорода образуют два простых вещества: кислород и озон, обладающих разным составом молекул, а, следовательно, и разными свойствами.
Таким образом, сходство в названиях элементов и простых веществ не должно приводить к отождествлению этих понятий.
Далеко не все сложные вещества состоят из молекул. Атомы химических элементов, соединяясь друг с другом, в одних случаях образуют молекулы, в других – более сложные структуры.
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения.
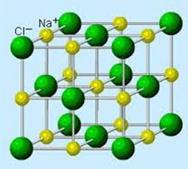
Атомы хлора и натрия в составе поваренной соли, соединяясь друг с другом, выстраиваются в строго определённом порядке, образуя кристалл.
Вещества, в кристаллах которых нет молекул, имеют немолекулярное строение. Атомы в немолекулярных кристаллах связаны друг с другом разными способами, но всегда очень прочно.
Такие вещества плавятся и переходят в газообразное состояние только при очень сильном нагревании, когда энергии достаточно, чтобы разрушить прочные связи, с помощью которых частицы удерживаются в кристалле.
Например, температура плавления поваренной соли равна 801° С. При нагревании этого соединения до 1465° С от поверхности кристалла начнут отрываться его мельчайшие частицы, состоящие из атомов натрия и хлора, т.е. будет происходить испарение. Тогда можно считать, что при этой температуре хлорид натрия существует в молекулярной форме.
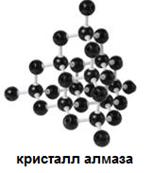
Все металлы, алмаз, графит, красный фосфор имеют немолекулярное строение.
А как же йод? Ведь это твёрдое кристаллическое вещество испаряется легче, чем вода. Кристаллы йода состоят не из атомов, а из молекул. Вещества молекулярного строения не столь прочны: молекулы в них связаны слабыми, легко разрушающимися связями. Поэтому вещества такого строения (йод, лёд, кристаллический углекислый газ) легкоплавки и летучи.
Таким образом, атомы химических элементов существуют в свободном виде либо в составе простых и сложных веществ. Простые вещества подразделяются на металлы и неметаллы. Существуют вещества молекулярного и немолекулярного строения. Кристаллы первых построены из молекул, кристаллы вторых – из атомов или образованных ими частиц. Атомы способны соединяться друг с другом разными способами. Свойства веществ обусловлены их строением.
Важнейшей характеристикой вещества является его состав: качественный и количественный. Качественный состав – это перечень всех образующих вещество химических элементов. Количественный состав – это число атомов каждого элемента в составе мельчайшей частицы вещества – его молекулы.
Состав сложных веществ – химических соединений - определяют экспериментально с помощью качественного и количественного анализа.

Французский химик Жозеф Луи Пруст в период с 1799 по 1806 годы исследовал состав ряда химических соединений. Он установил, что многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав. Это положение получило название закон постоянства состава.
Это означало, например, что все молекулы углекислого газа, содержащегося в воздухе классной комнаты или леса, а также образующего брикет сухого льда, которым охлаждают мороженое, или газа, полученного при прокаливании известняка либо гашении соды уксусом, всегда имеют один и тот же состав. Каждая молекула образована атомом углерода и связанными с ним двумя атомами кислорода.
Позже было обнаружено, что данный закон распространяется далеко не на все химические соединения и область его применения не столь широка. Однако в начале XIX века он сыграл в науке весьма важную роль, поскольку создал теоретическую основу для выражения состава веществ с помощью химических формул.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!