Мы уже знаем, что при образовании ионной химической связи между атомами разных по характеру элементов происходит полное или частичное перемещение валентных электронов к более электроотрицательному атому с образованием ионов.
Для обозначения их истинного или условного заряда в соединении введено понятие «степень окисления».
Напомню, что степень окисления– это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
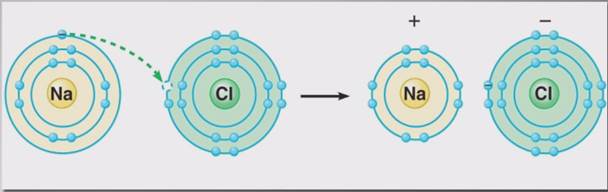
В ионных соединениях степень окисления отражает истинный заряд ионов, что связано с переходом электронов от атомов металла к атомам неметалла, как, например, при образовании хлорида натрия. Отдав свой электрон атому хлора, атом натрия приобретает положительный заряд и превращается в катион натрия Na+. Атом хлора, приобретая электрон натрия, приобретает отрицательный заряд, превращаясь в хлорид-анион Cl-.
Образование ионной связи можно представить в виде двух процессов.

Первый – отдача электрона атомом натрия и превращение его в катион натрия – это окисление. Второй – присоединение электрона атомом хлора и превращение его в хлорид-анион – это восстановление.
Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Эти два процесса взаимосвязаны, так как электроны от одного атома переходят к другому атому. В обоих случаях это приводит к образованию устойчивых электронных структур.
Вещество, в состав которого входят атомы элемента, способного отдавать электроны, то есть повышать степень окисления, называется восстановителем. К восстановителям относятся атомы и простые вещества – металлы, молекулярный водород, сероводород, аммиак, оксид углерода (II) и другие. В процессе отдачи электронов восстановитель окисляется.
Вещество, в состав которого входят атомы элемента, способного притягивать электроны, то есть понижать степень окисления, называется окислителем.
Окислитель (галогены, кислород, кислоты и другие вещества) в этом процессе восстанавливается.
Восстановитель (металлы, водород, углерод и другие) окисляется.
Поместим 1-2 гранулы цинка в пробирку и добавим несколько мл соляной кислоты. На поверхности цинка образуются пузырьки газа, которые быстро поднимаются вверх. Этот газ – водород. Цинк постепенно растворится, превратившись в растворимый хлорид цинка. Zn + 2HCl→ZnCl2 + H2↑.
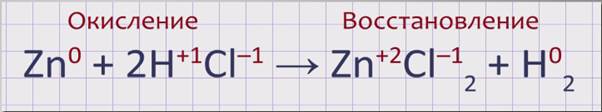
Расставим степени окисления над формулами веществ, участвующих в реакции. Степень окисления цинка в простом веществе цинк равна 0, в соляной кислоте водород имеет степень окисления +1, хлор -1. В хлориде цинка степень окисления цинка +2, хлора -1. Степень окисления водорода в простом веществе водород равна 0.
Zn0 + 2H+1Cl-1→ Zn+2Cl-12 + H02.
В данной реакции происходят два процесса. Первый, окисление – отдача электронов атомом цинка, восстановителем и приобретение им степени окисления +2. Второй, восстановление – присоединение электронов атомами водорода, окислителем и превращение их в нейтральную молекулу водорода.
В этих реакциях процессы окисления и восстановления взаимосвязаны. Особенность таких реакций заключается в том, что, кроме разрушения старых связей в исходных веществах и образования новых в продуктах реакции, происходит изменение степеней окисления атомов реагирующих веществ.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!