В лабораторной практике часто приходится использовать растворы щелочей. А как они выглядят в твердом состоянии? Познакомимся поближе с наиболее распространенными щелочами и имеющими самое широкое применение.
Это гидроксиды натрия, калия и кальция. Все перечисленные гидроксиды очень похожи.

Это едкие кристаллические вещества белого цвета, очень гигроскопичные. На ощупь они мылкие, своё название «едкие» оправдывают тем, что при попадании на кожу вызывают ожоги, разрушают многие органические вещества, в том числе шерсть и шелк.
При работе со щелочами следует соблюдать правила техники безопасности. Кристаллические щелочи следует брать только шпателем (или пинцетом). При попадании раствора щелочи на кожу необходимо смыть раствор большим количеств воды до исчезновения ощущения мылкости, а затем нейтрализовать раствором борной кислоты.

Гидроксиды натрия и калия выпускают в виде плоских гранул. Если несколько таких гранул пинцетом положить на часовое стекло и оставить на воздухе, то через 15-20 минут можно будет наблюдать, как они растекутся, растворившись в воде, поглощенной из воздуха.
При растворении щелочи в воде выделяется большое количество теплоты.

Едкие щелочи широко используют в различных химических производствах, в частности при изготовлении мыла, красок (например, гуаши), в щелочных аккумуляторах.
С глубокой древности человек использует гидроксид кальция, например, в составе хорошо известного вам строительного материала бетона, он служит человечеству более 2000 лет. Гидроксид получают путём гашения: взаимодействия с водой негашёной извести – оксида кальция. Реакцию взаимодействия оксида с водой сопровождает выделение большого количества тепла: СаО + Н2О → Са(ОН)2 + Q.

Реакция гашения негашёной извести может быть рассмотрена как один из способов получения щелочей. Гидроксид кальция малорастворим в воде. Его раствор, называемый известковой водой, обладает всеми свойствами растворов щелочей.
Щелочи могут быть получены путем взаимодействия с водой оксидов щелочных и щёлочноземельных металлов: ВаО + Н2О = Ва(ОН)2.
Другим способом получения щелочей в лаборатории является растворение металлов в воде. Убедимся в этом на опыте. В кристаллизатор с водой добавим несколько капель фенолфталеина и поместим небольшой кусочек металлического натрия. Натрий, плотность которого меньше, чем у воды, не тонет и бурно реагирует с водой. Под влиянием выделяющегося в ходе реакции тепла он расплавляется, превращается в блестящий серебристый шарик. Этот шарик быстро перемещается, «бегает» по поверхности воды, одновременно растворяясь. Окраска фенолфталеина становится малиновой, это свидетельствует об образовании щелочи NаОН.

Гидроксиды лития, натрия и калия устойчивы к нагреванию. Например, едкий натр способен кипеть при температуре, равной 1400оС, не разлагаясь.
Изучая свойства оксидов и кислот, мы уже рассмотрели часть химических свойств, которые характерны для щелочей. Обобщим и расширим имеющиеся знания.
Растворимые основания реагируют с кислотными оксидами. В реакциях между щелочью и кислотными оксидами образуются соль и вода.
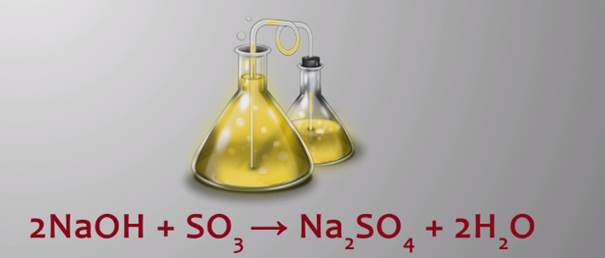
Тип реакций – обмен. Например, при пропускании через раствор гидроксида натрия оксида серы (VI) образуется сульфат натрия и вода. 2NaOH + SO3→Na2SO4 + 2H2O.
Щелочи взаимодействуют с кислотами. Это уже известная нам реакция нейтрализации (реакция обмена): NaОН + НCl→NaCl + H2O.
Большинство реакций нейтрализации экзотермические. Подтвердить экзотермичность реакции поможет термоскоп. Термоскоп состоит из пробирки с узкой трубкой. В пробирке находится подкрашенная жидкость. Если опустить прибор в смесь реагирующих веществ, то можно наблюдать подъем жидкости в трубке термоскопа, ее объем увеличивается вследствие повышения температуры.
Щелочи взаимодействуют с растворимыми солями. Чтобы не допустить ошибки при подборе примеров, иллюстрирующих данное свойство щелочей, следует справиться о растворимости соли по таблице растворимости.
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓. Тип реакции – обмен.
Таким образом, щелочи (растворимые вещества) – химически активные вещества, они вступают в химическое взаимодействие с кислотными оксидами, кислотами и растворимыми солями. Во всех случаях одним из продуктов взаимодействия оказывается соль.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!