Большая часть металлов и неметаллов способна вступать в цепочки последовательных превращений, в результате которых из простых веществ можно получить их оксиды и гидроксиды.
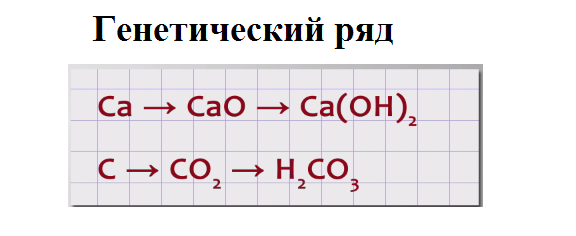
Такие цепочки в химии называются генетическими рядами, так как они отражают генезис (происхождение) разных классов соединений и связи между ними. Приведём пример таких рядов: Са → СаО → Са(ОН)2, С → СО2 → Н2СО3.
Чтобы хорошо разобраться в химических свойствах кислот, в первую очередь следует помнить, что все они, как правило, способны вступать во взаимодействие со всеми членами генетического ряда металлов: самими металлами, их оксидами и гидроксидами. Рассмотрим на примерах общие свойств кислот.
Кислоты вступают во взаимодействие с металлами. В четыре пробирки поместим по одной-две стружки или гранулы металлов: магния, цинка, железа и меди. К металлам прильем разбавленные растворы серной или соляной кислот.
В трех первых пробирках протекают химические реакции. На поверхности металлов образуются пузырьки газа, которые быстро поднимаются вверх. Этот газ – водород. Мы познакомились с ним при изучении реакции разложения воды электрическим током. При поджигании выделяющегося водорода происходит характерный хлопок.
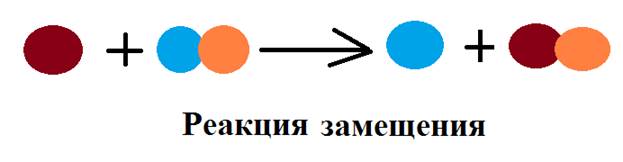
Например, в первой пробирке происходит реакция, которую можно описать следующим уравнением: Mg + H2SO4 → MgSO4 + H2↑. Аналогично происходят реакции во второй и третьей пробирках: Zn + H2SO4 → ZnSO4 + H2↑, Fe + H2SO4 → FeSO4 + H2↑. Тип реакции – замещение.
В четвертой пробирке никаких видимых изменений не происходит: медь не реагирует с растворами кислот.
Дело в том, что возможность протекания реакции металлов с кислотами зависит от реакционной способности металлов, которая определяет их положение в ряду активности металлов. Для рассматриваемых нами свойств кислот важно знать следующее: металлы, стоящие в этом ряду после водорода, не вытесняют его из растворов кислот.
Кислоты реагируют с основными оксидами. С этой группой реакций мы уже познакомились при изучении свойств основных оксидов.
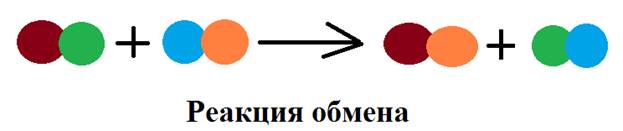
Поместим в пробирку небольшое количество оксида железа (II). Прильем к нему несколько капель раствора серной кислоты. Мы заметим, что красный порошок оксида железа (II) исчезает, а раствор приобретает желто-бурую окраску. В результате реакции образуется соль – сульфат железа (II), раствор которой желто-бурого цвета. Уравнение реакции: FeO + H2SO4 → FeSO4 + H2O. Тип реакции – обмен.
Кислоты могут взаимодействовать с растворимыми основаниями (щелочами).
К 2-3 мл раствора соляной кислоты добавим 2-3 капли раствора лакмуса. Окраска индикатора изменилась с фиолетовой на красную. Затем по каплям прильем раствор гидроксида натрия и проследим за изменением окраски индикатора: от красной до фиолетовой и затем до синей.
В кислой среде лакмус окрашивается в красный цвет. По мере приливания щелочи происходила нейтрализация кислой среды, и возникала нейтральная (не кислая, не щелочная) среда, поэтому лакмус окрасился в фиолетовый цвет. Если щелочи прилить столько, что ее количество будет превышать количество кислоты, тогда эта избыточная, не прореагировавшая с кислотой щелочь окрасит лакмус в синий цвет.
Итак, в процессе взаимодействия кислоты и щелочи происходит нейтрализация среды, поэтому такие реакции называют реакциями нейтрализации. При этом образуется соль и вода. HCl + NaOH → NaCl + H2O. Тип реакции – обмен.
Кислоты могут реагировать и с нерастворимыми основаниями. К нерастворимому гидроксиду железа (III) прильем раствор серной кислоты. Осадок гидроксида железа (III) растворится, раствор приобретет желто-бурый цвет. В результате данной реакции образуется растворимая соль – сульфат железа (III) и вода.
Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O. Тип реакции – обмен.
Итак, кислоты реагируют не только с растворимыми, но и с нерастворимыми основаниями. А в результате реакций образуются те же продукты – соль и вода.
Таким образом, кислоты – химически активные вещества, они вступают в химическое взаимодействие с металлами, их оксидами и гидроксидами – растворимыми и нерастворимыми. Во всех случаях одним из продуктов взаимодействия оказывается соль.
 Подпишись и будь
в курсе новых событий и новостей!
Подпишись и будь
в курсе новых событий и новостей!